Siltuma daudzums
Iekšējā enerģija un temperatūra
Enerģiju, ko nosaka sistēmas daļiņu kustība un mijiedarbība, sauc par šīs sistēmas iekšējo enerģiju (skatīt nodaļu ''Iekšējā enerģija'').
Lai aprēķinātu kādas sistēmas iekšējo enerģiju, ir jāzina sistēmas uzbūve (mikrostruktūra), sistēmas daļiņu kustības un mijiedarbības raksturs. Aplūkojot siltumparādības un procesus pieņem, ka iekšējā enerģija ir atkarīga tikai no vielas daļiņu - molekulu (atomu) termiskās kustības un to savstarpējās mijiedarbības, neaplūkojot, piemēram, atoma kodolus veidojošo daļiņu mijiedarbību.
Pieņemsim, ka izolētā traukā, kuram ir šķērssiena, atdalītos tilpumos \(V_1\) un \(V_2\) dažādās temperatūrās atrodas gāze vai šķidrums (1. attēls). Šāds trauks ir it kā divas atsevišķas termodinamiskas sistēmas, kuru kopējā iekšējā enerģija (\(U\)) nemainās: \(U=U_1+U_2=const\).
1.att.
Taču abas sistēmas neatrodas savstarpējā siltuma (termiskajā) līdzsvarā, jo to temperatūras ir atšķirīgas, un tāpēc tās var savstarpēji iedarboties caur šķērssienu - iekšējo enerģiju apmaiņa tomēr notiek, līdz iestājas siltuma līdzsvars un temperatūra izlīdzinās (kādēļ tā, skatīt nodaļās ''Siltumkustība un temperatūra'' un ''Otrais termodinamikas likums'').
Tā, piemēram, 2. attēlā redzams, ka telpā ienesta glāze ar karstu ūdeni, kura temperatūra ir augstāka nekā telpas temperatūra, atdziest - siltums no glāzes aizplūst apkārtējā telpā. Tas notiks līdz brīdim, kad telpas un glāzes temperatūras kļūs vienādas.
2.att.
Viena sistēma enerģiju \(\Delta{U}\) atdod (tagad: \(U_1\) - \(\Delta{U}\)), bet otra sistēma tikpat daudz enerģijas saņem (tagad: \(U_2+\Delta{U}\)).
Siltuma daudzums un siltumapmaiņa
Procesu, kurā notiek iekšējās enerģijas izmaiņa, nepastrādājot mehānisko darbu, sauc par siltumapmaiņu jeb siltuma pārnesi.
Ir trīs siltuma pārneses veidi: siltumvadīšana, kad siltums pāriet no siltāka ķermeņa (vai tā daļas) uz aukstāku ķermeni šo ķermeņu tiešā kontaktā (skatīt nodaļu ''Siltumvadīšana''), konvekcija — siltumapmaiņa, pārvietojoties vielai ar dažādu temperatūru (skatīt nodaļu ''Konvekcija'') un siltumstarojums, kad enerģiju pārnes elektromagnētiskie viļņi — termiskais starojums (skatīt nodaļu ''Siltuma starojums'').
Ja ķermenis uzņem vai atdod siltumenerģiju, tad tā iekšējā enerģija palielinās vai samazinās.
Tā rezultātā ķermeņa temperatūra paaugstinās vai pazeminās, var arī notikt agregātstāvokļa maiņa.
Dabā un sadzīvē bieži notiek vairāku ķermeņu siltumapmaiņa – vieni ķermenis siltumenerģiju saņem, bet citi atdod.
Iekšējās enerģijas daudzumu, ko ķermenis iegūst vai zaudē siltumapmaiņas procesā, sauc par siltuma daudzumu (\(Q\)).
Tā kā siltuma daudzums ir enerģija, \([Q]=J\)
Saskaņā ar pirmo termodinamikas likumu \(Q=\Delta{U}+A\) (skatīt nodaļu ''Pirmais termodinamikas likums''), ja sistēma ir noslēgta un netiek veikts mehāniskais darbs, siltumapmaiņas procesā vienu (piemēram sasilušo) ķermeņu iekšējā enerģija palielinās tieši par tik, par cik samazinās otru (piemēram, atdzisušo) ķermeņu iekšējā enerģija.
Tātad: \(Q=\Delta{U}\)
Sistēma, kas siltuma daudzumu jeb siltumu \(Q\) atdod, ir ''karstāka'', bet sistēma, kas to saņem, — ''aukstāka''. Ja ķermenis siltuma daudzumu saņem, šo siltuma daudzumu uzskata par pozitīvu, ja atdod – par negatīvu.
Tātad, ja starp ķermeņiem, kas veido izolētu sistēmu, notiek tikai siltumapmaiņa, tad, saskaņā ar pirmo termodinamikas likumu, ķermeņu atdotais siltuma daudzums \(Q_\mathrm{A}\) un citu ķermeņu saņemtais siltuma daudzums \(Q_\mathrm{S}\) ir skaitliski vienādi: \(Q_\mathrm{A}=Q_\mathrm{S}\)
Ķermeņi, kuri atdziest un/vai kondensējas un/vai sacietē noteiktu siltuma daudzumu atdod, bet citi ķermeņi, kuri sasilst un/vai kūst un/vai iztvaiko, šo siltuma daudzumu saņem.
Ir jāņem vērā visu siltumapmaiņā piedalījušos ķermeņu temperatūras un/vai agregātstāvokļu izmaiņa.
Jāpiebilst, ka jēdziens ''siltuma daudzums'' nozīmē iekšējās enerģijas izmaiņu, bet ne iekšējās enerģijas daudzumu vispār. Dažkārt ikdienā sastopamajai frāzei, ka ''ķermenis satur noteiktu siltuma daudzumu'', nav fizikālas jēgas. Ķermenim var ''atņemt'' vai ''piešķirt'' noteiktu siltuma daudzumu, bet ķermenī siltuma daudzuma kā tāda nav.
Siltuma daudzumu ķermeņi var saņemt gan notiekot siltuma apmaiņai noslēgtā sistēmā, kad vieni ķermeņi siltumu atdod, citi saņem, gan arī no sildītāja - parasti siltumam izdaloties eksotermiskās ķīmiskās reakcijās (kurināmajam sadegot - skatīt nodaļu ''Kurināmā sadegšana'') vai no elektriskajiem sildītājiem.
Lai gan siltuma daudzuma SI mērvienība ir džouli (\(J\)), sadzīvē bieži tiek lietota vēl viena mērvienība – kalorija (\(cal \)). Viena kalorija ir 4,19 \(J\) jeb 1\(J\) = 0,24 \(cal\). Kalorija ir siltuma daudzums, kas nepieciešams, lai vienu gramu ūdens sasildītu par vienu Celsija grādu.
Īpatnējā siltumietilpība
Ja ķermenis uzņem vai atdod siltumenerģiju, tad tā iekšējā enerģija palielinās vai samazinās.
Tā rezultātā ķermeņa temperatūra paaugstinās vai pazeminās, var arī notikt agregātstāvokļa maiņa.
Dabā un sadzīvē bieži notiek vairāku ķermeņu siltumapmaiņa – vieni ķermenis siltumenerģiju saņem, bet citi atdod.
Iekšējās enerģijas daudzumu, ko ķermenis iegūst vai zaudē siltumapmaiņas procesā, sauc par siltuma daudzumu \(Q\) (skatīt nodaļu ''Siltuma daudzums'').
Ķermeņi, kuri atdziest, noteiktu siltuma daudzumu atdod, jo to iekšējā enerģija samazinās, bet ķermeņi, kuri sasilst, siltuma daudzumu saņem.
Noskaidrosim, no kā atkarīgs siltuma daudzums, kas nepieciešams vielas sasildīšanai (tās temperatūras paaugstināšanai).
Ja divās vienādās elektriskajās tējkannās silda atšķirīgu daudzumu ūdens, tad tējkannas sildelementa izdalītais siltums pāriet uz ūdeni. Lai sasildītu lielāko ūdens daudzumu par vienādu skaitu grādu, nepieciešams ilgāks laiks - tam jāpievada lielāks siltuma daudzums.
Arī vienāda ūdens daudzuma sasildīšanai līdz augstākai temperatūrai nepieciešams vairāk siltuma.
Savukārt, ja, piemēram, sakarsētu metāla gabalu ieliek traukā ar aukstu ūdeni, tad ūdens sasilst un metāla gabala un ūdens temperatūras pakāpeniski izlīdzinās. Jo lielāka ir metāla gabala masa, jo lielāku siltuma daudzumu tas atdod ūdenim un ūdens sasilst līdz augstākai temperatūrai.
Bet, ja uz vienādiem sildītājiem vienādi ilgi silda vienādu ūdens un eļļas daudzumu, tad var novērot, ka eļļa sasilst vairāk. Tas nozīmē, ka siltuma daudzums, kas nepieciešams sasildīšanai, ir atkarīgs no ķermeņa vielas.
Tātad, eksperimentos konstatēts, ka siltuma daudzums, kas nepieciešams ķermeņa sasildīšanai vai arī izdalās, ķermenim atdziestot, ir atkarīgs no:
- ķermeņa masas (\(m\));
- ķermeņa temperatūras izmaiņas \(\Delta{t}=t_2-t_1\) (kur \(t_1\) – tā sākuma temperatūra, bet \(t_2\) – beigu temperatūra);
- vielas, no kā ķermenis izgatavots. Ikvienu vielu raksturo tabulās atrodams eksperimentāli noteikts fizikāls lielums – īpatnējā siltumietilpība (\(c\)).
\(Q=cm(t_2-t_1)\)
Vielas īpatnējā siltumietilpība \(c\) vienāda ar saņemto vai atdoto siltuma daudzumu, ja 1 kg vielas temperatūra mainās par 1 \(K\).
\([c]=\frac{J}{(kg\cdot{K})}\)
Tā ir tikai vielas īpašība. Katrai vielai ir sava \(c\) vērtība.
Izmēģini animāciju par siltumietilpību!
Dažādām vielām siltumietilpība var krasi atšķirties, kā tas redzams 1. attēlā. Praktiski vislielākā īpatnējā siltumietilpība ir šķidram ūdenim, un tas ir vēl viens pierādījums ūdens unikālajām īpašībām. Ūdens ir bijis noteicošais faktors, lai uz Zemes rastos dzīvība, kas spēj pastāvēt vēl šobaltdien.
1.att. Dažādu vielu siltumietilpība
Ūdens īpatnējā siltumietilpība
Cilvēka ķermenis lielā mērā sastāv no ūdens, tādēļ, lielās ūdens īpatnējās siltumietilpības dēļ, tas salīdzinoši lēni sasilst vai atdziest. Iespējams nav nejaušība, ka ūdens īpatnējajai siltumietilpībai ir neliels minimums aptuveni mūsu ķermeņu temperatūrā (2. attēls).
2.att. Ūdens īpatnējā siltumietilpība atkarībā no temperatūras
Vasarā ūdens uzkrāj ļoti daudz siltuma. Ūdens sasildīšanai nepieciešams ilgs laiks, tādēļ pie jūras vasaras sākumā ir aukstāks nekā dziļāk kontinentā. Savukārt ziemas ir siltākas, jo ziemā ūdens uzkrāto enerģijas daudzumu atdod. Ikdienā siltumietilpības ietekmi var sajust mākoņainās vasaras dienās. Apkārtējam gaisam ir maza siltumietilpība, līdz ar to, kad spīd Saule, mums ir silti, savukārt tiklīdz Saule beidz spīdēt, mums diezgan ātri kļūst vēsi, jo gaiss ir uzkrājis maz siltuma enerģijas.
Arī sadzīvē bieži lietotā enerģijas mērvienība kalorija (\(cal\)) saistīta ar ūdens siltumietilpību - viena kalorija ir siltuma daudzums, kas vajadzīgs, lai vienu gramu ūdens uzsildītu par vienu Celsija grādu.
Gāzu īpatnējā siltumietilpība
Jāuzmanās ar gāzu īpatnējo siltumietilpību, jo izrādās, ka vienai un tai pašai gāzei siltumietilpība izohoriskā un izobāriskā procesā ir atšķirīga (3. attēls) Izobāriskā procesā gāzei ir lielāka siltumietilpība (skatīt nodaļu ''Ideālās gazes siltumietilpība'').
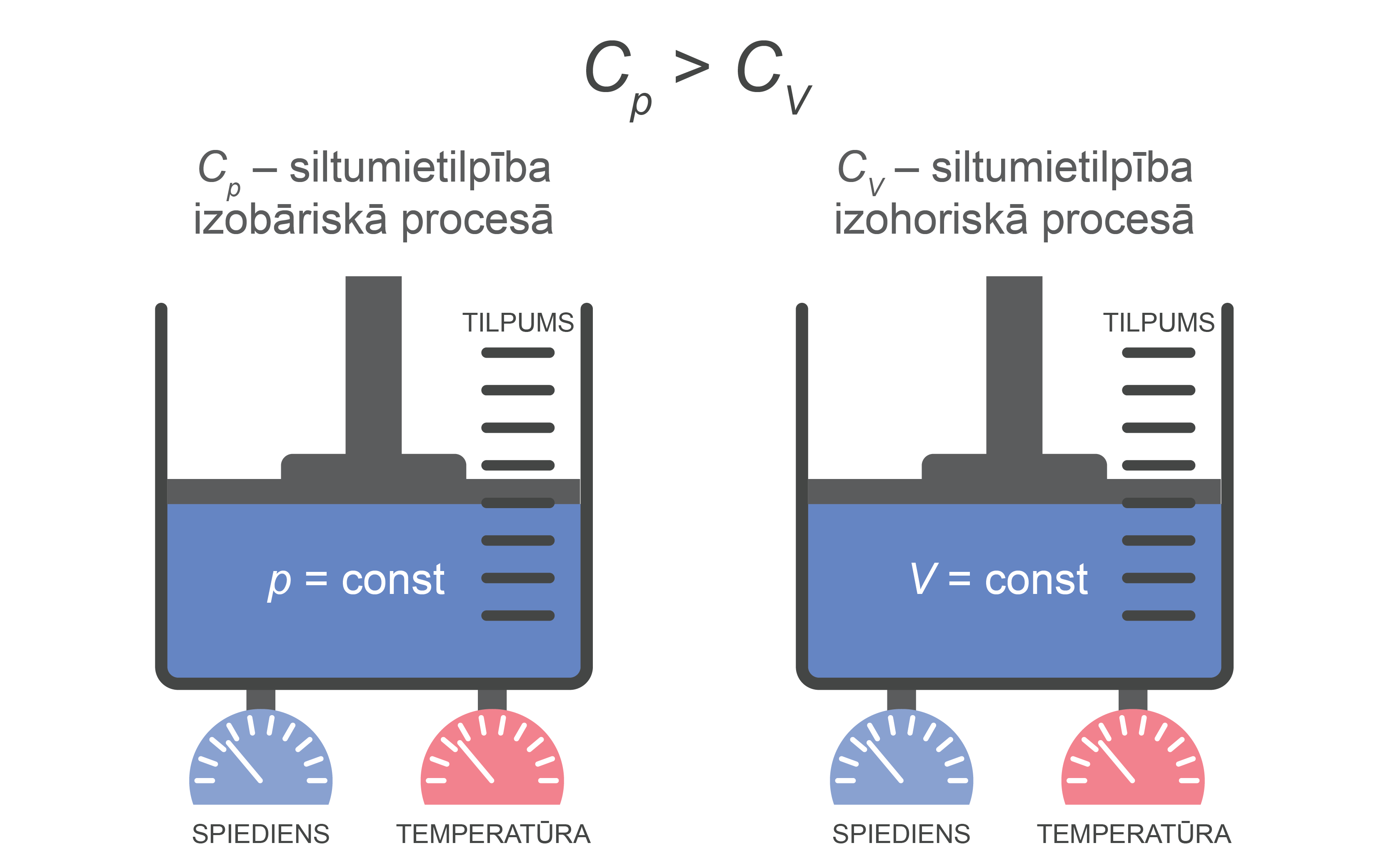
3.att. Gāzes siltumietilpības salīdzinājums dažādos procesos
Ķermeņu temperatūras izmaiņu laikam ejot vai atkarībā no pievadītā siltuma daudzuma ir ērti attēlot grafiski – to aplūkosim nodaļā ''Siltuma procesu grafiki''.
Ķermeņa siltumietilpība
Ja ķermenis sastāv no vairākām vielām, ērtāk izmantot citu raksturlielumu:
ķermeņa siltumietilpību (\(C\)).
Ķermeņa siltumietilpība ir saņemtais vai atdotais siltuma daudzums, ja ķermeņa temperatūra mainās par 1 \(K\). Tā ir ķermeņa īpašība un atkarīga gan no ķermeņa masas, gan ari no vielas vai vielām, kas veido ķermeni. Tādēļ katram ķermenim tā ir sava un jānosaka katram ķermenim atsevišķi.
\([C]=\frac{J}{K}\)
\(Q=C(t_2-t_1)\)
Ķermeņa siltumietilpība var būt rakstīta ierīču, piemēram, tējkannas, pasē.
Kurināmā sadegšana
Siltuma daudzumu (skatīt nodaļu ''Siltuma daudzums'') ķermeņi var saņemt gan notiekot siltuma apmaiņai noslēgtā sistēmā, kad vieni ķermeņi siltumu atdod, citi saņem, gan arī no sildītāja - parasti siltumam izdaloties eksotermiskās ķīmiskās reakcijās (kurināmajam sadegot) vai no elektriskajiem sildītājiem.
Ļoti bieži siltumenerģiju, ko pievadīt vielai, iegūst dažāda veida kurināmā – naftas, ogļu, malkas, dabasgāzes, arī citu kurināmā veidu sadegšanas rezultātā.
Sadegot dažāda veida kurināmajam, izdalās atšķirīgs siltuma daudzums \(Q\).
Šo īpašību raksturo kurināmā siltumspēja \(q\).
Kurināmā siltumspēja (īpatnējais sadegšanas siltums) \(q\) ir siltuma daudzums, kas izdalās, pilnīgi sadegot 1 kg kurināmā.
\(q=\frac{Q}{m}\)
\([q]=\frac{J}{kg}\)
Tātad, kurināmajam sadegot izdalīto siltuma daudzumu var aprēķināt pēc formulas \(Q=qm\)
Izvēloties kurināmā veidu, ir ļoti svarīgi zināt šo īpatnējo sadegšanas siltumu, lai zinātu, cik daudz siltuma varēs iegūt no viena kg degvielas (1. attēls), tomēr svarīgi ir arī citi faktori, piemēram, cik lielu piesārņojumu rada konkrētā kurināmā izmantošana. Tabulā, salīdzinājumam, iekļauta arī kodoldegviela, lai gan šajā gadījumā degšana nenotiek.
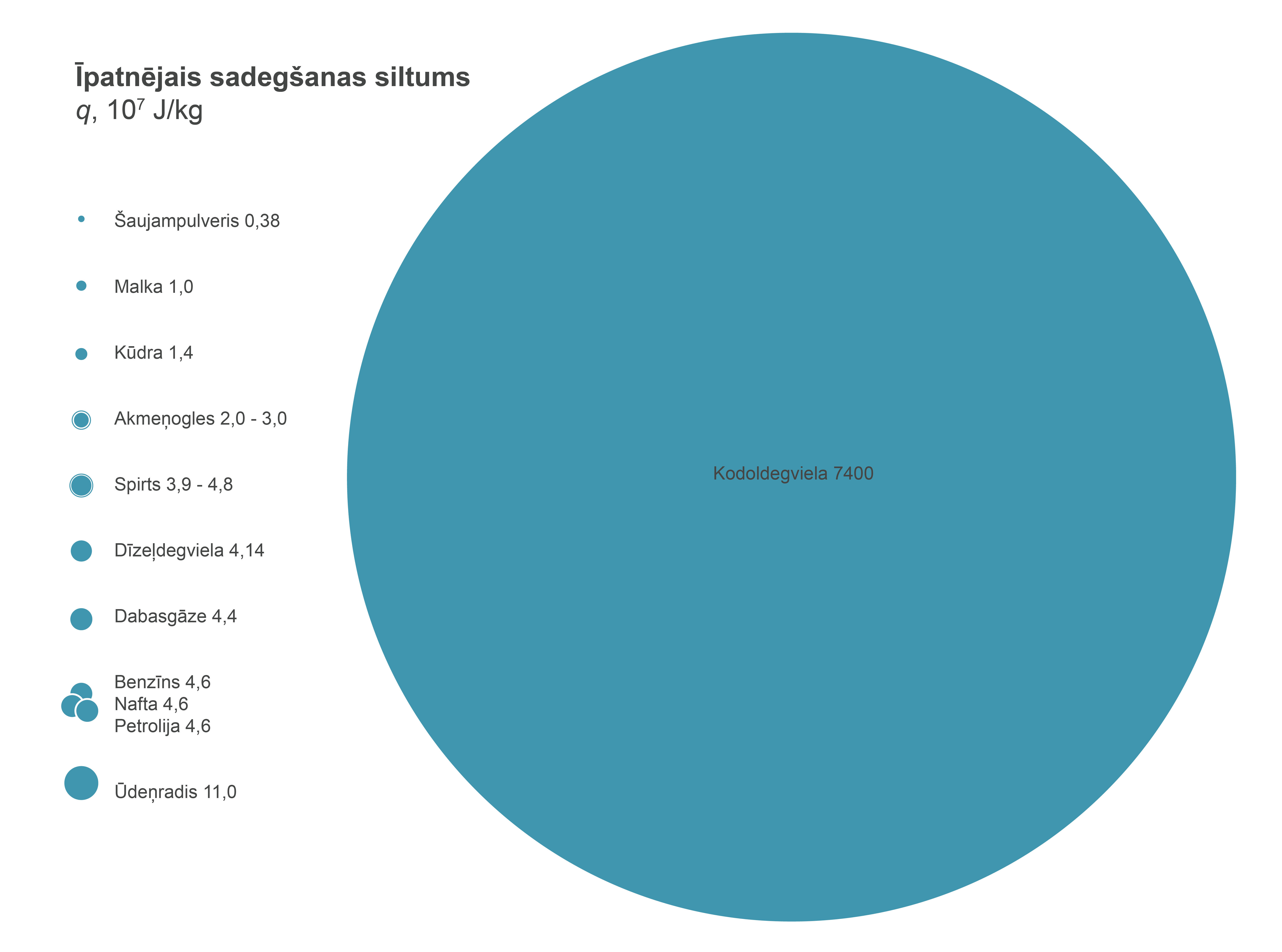
1.att. Dažādu kurināmo īpatnējā siltumspēja
Produktu enerģētiskā vērtība
Arī uz pārtikas produktiem norādītā enerģētiskā vērtība būtībā ir ''kurināmā siltumspēja'' – tā parāda, cik daudz enerģijas izdalīsies vielmaiņas procesā.
Tā kā būtiska cilvēka ķermeņa sastāvdaļa ir ūdens, produktu enerģētisko vērtību parasti norāda kalorijās uz noteiktu produkta masu, parasti 100 g, jo kalorija ir siltuma daudzums, kas nepieciešams, lai vienu gramu ūdens sasildītu par vienu Celsija grādu. Viena kalorija ir 4,19 \(J\) jeb 1\(J\) = 0,24 \(cal \).
Enerģiju, ko var iegūt no pārtikas, var salīdzināt arī ar ''mehānisku ekvivalentu''. Piemēram, ja enerģijas batoniņš satur 115 \(kcal\) enerģijas, tas ir vienāds ar aptuveni 0,48 \(MJ\) enerģijas. Ar to pietiek, lai metra augstumā paceltu 48 \(t\) smagu kravu (2. attēls)
2.att. Enerģijas batoniņā noslēptā enerģija
Siltuma bilance
Ja ķermenis uzņem vai atdod siltumenerģiju, tad tā iekšējā enerģija palielinās vai samazinās.
Tā rezultātā ķermeņa temperatūra paaugstinās vai pazeminās, var arī notikt agregātstāvokļa maiņa.
Iekšējās enerģijas daudzumu, ko ķermenis iegūst vai zaudē siltumapmaiņas procesā, sauc par siltuma daudzumu (\(Q\)). (skatīt nodaļu ''Siltuma daudzums'')
Ja starp ķermeņiem, kas veido izolētu sistēmu, notiek tikai siltumapmaiņa, tad, saskaņā ar pirmo termodinamikas likumu, ķermeņu atdotais siltuma daudzums \(Q_\mathrm{A}\)un citu ķermeņu saņemtais siltuma daudzums \(Q_\mathrm{S}\) ir vienādi:
\(Q_\mathrm{A}=Q_\mathrm{S}\)
Šo vienādojumu sauc par izolētas sistēmas siltuma bilances vienādojumu.
Sistēma, kas siltuma daudzumu jeb siltumu \(Q\) atdod, ir ''karstāka'', bet sistēma, kas to saņem, — ''aukstāka''.
Ja ķermenis siltuma daudzumu saņem, šo siltuma daudzumu uzskata par pozitīvu, ja atdod – par negatīvu.
Rakstot siltuma bilances vienādojumus, ērtības labad var aplūkot siltuma daudzumu moduļus, tādā gadījumā siltuma daudzuma aprēķina formulās rakstot temperatūras izmaiņas moduļus (no augstākās temperatūras vienmēr atņemot zemāko).
Ķermeņi, kuri atdziest un/vai kondensējas un/vai sacietē noteiktu siltuma daudzumu atdod, bet citi ķermeņi, kuri sasilst un/vai kūst un/vai iztvaiko, šo siltuma daudzumu saņem.
Ir jāņem vērā visu siltumapmaiņā piedalījušos ķermeņu temperatūras un/vai agregātstāvokļu izmaiņa.
Tā kā siltuma apmaiņai beidzoties visu tajā piedalījušos ķermeņu temperatūra ir vienāda, uzdevumus risinot to ērtības dēļ mēdz apzīmēt ar grieķu burtu ''teta'' (\(\Theta\)).
Ja siltuma procesā norisinās arī fāžu pārejas, tad, sastādot siltuma bilances vienādojumu, ir jāņem vērā ne tikai ķermeņu temperatūrai mainoties (sasilstot vai atdziestot) saņemtais vai atdotais siltuma daudzums, kuru izsaka pēc formulas
\(Q=cm\Delta{t}\)
bet arī siltuma daudzums, kas saņemts iztvaikojot vai atdots kondensējoties
\(Q=Lm\)
un siltuma daudzums, kas saņemts kūstot vai atdots kristalizējoties
\(Q=\lambda{m}\)
Šeit \(c\) – vielas īpatnējā siltumietilpība, \(L\) — īpatnējais iztvaikošanas siltums un \(\lambda\) — īpatnējais kušanas siltums.
Kalorimetri
Siltuma bilances mērījumiem lieto kalorimetrus.
Visvienkāršākais kalorimetrs ir divi savstarpēji izolēti trauki, telpu starp kuriem piepilda materiāls ar mazu siltumvadītspēju, piemēram, gaiss (1. att. a). Kalorimetra iekšējā trauka siltumietilpībai jābūt zināmai, lai to varētu ņemt vērā, veicot aprēķinus. Iekšējā traukā ielej šķidrumu un ievieto vielas, starp kurām notiek siltumapmaiņa un ievieto termometru temperatūras mērīšanai. Termometrs un sildierīce, kuru siltumietilpības zināmas, var būt iekļauti kalorimetra komplektā (1. att. b).
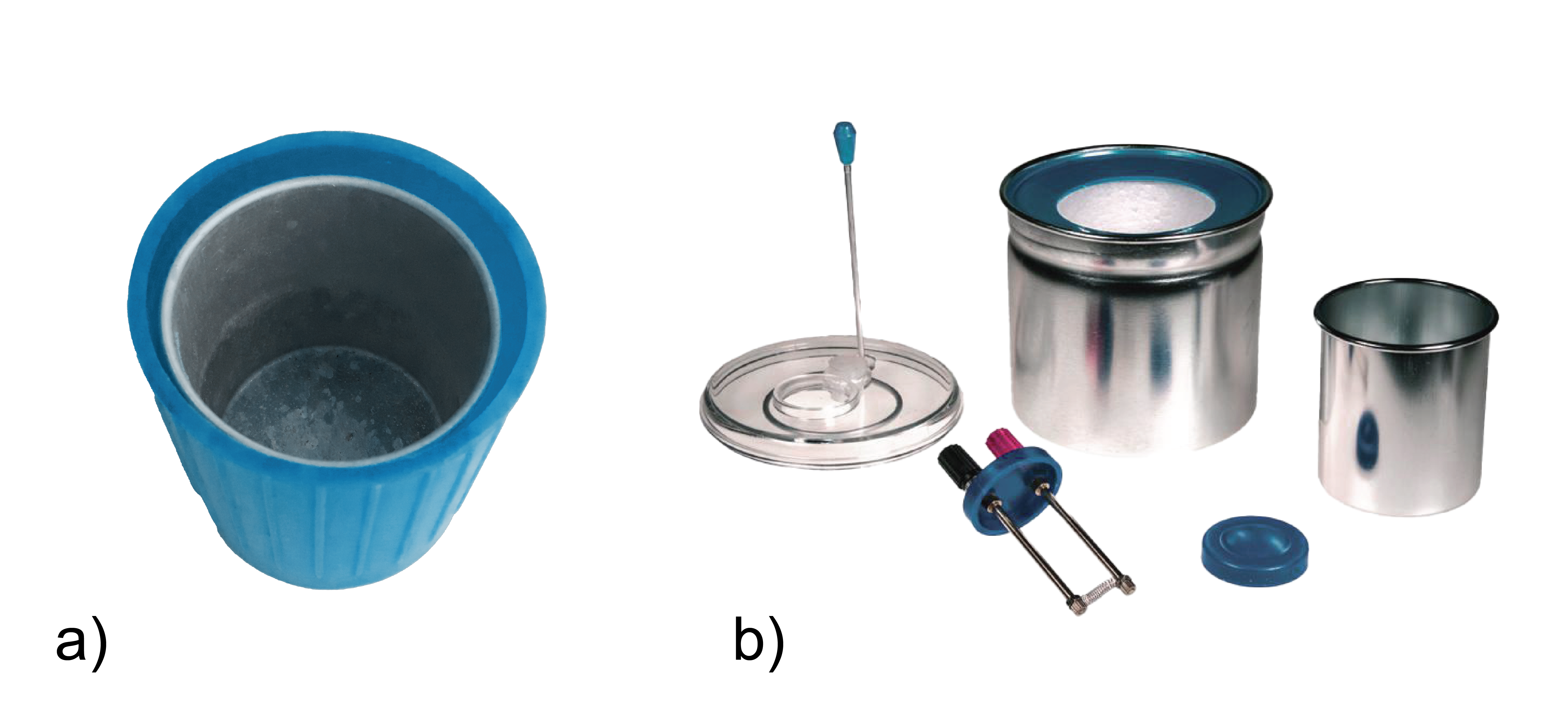
1.att. Vienkārši kalorimetri
Aplūkosim piemēru:
Kalorimetrā, kura siltumietilpība ir neievērojami maza ielika 100 g ledus, kura sākuma temperatūra ir – 20 °C un ielaida tvaiku (+100 °C). Kad iestājās siltuma līdzsvars, ūdens temperatūra traukā bija + 60 °C. Jāaprēķina ielaistā tvaika masu.
\(m_\mathrm{L}=\) \(0,1\) \(kg\) \(c_\mathrm{L}=\) \(2200\)\(J/(kg\cdot{K})\) \(c_\mathrm{Ū}=\) \(4200\) \(J/(kg\cdot{K})\) \(t_\mathrm{TV}=\) \(+100\) °C \(t_\mathrm{KUŠ}=\) \(0\) °C \(t_\mathrm{L}=\) \(-\)\(20\) °C \(L=\) \(22,6\cdot10^5\) \(J/kg\) \(\lambda=\) \(3,34\cdot10^5\) \(J/kg\) \(\Theta\) \(=\) \(60\) °C | \(Q_\mathrm{A}=Q_\mathrm{S}\) Siltumu atdod tvaiks kondensējoties un atdziestot (kā ūdens) līdz beigu temperatūrai \(\Theta\).
Siltumu saņem ledus, sasilstot līdz kušanas temperatūrai, izkūstot u sasilstot (kā ūdens) līdz beigu temperatūrai \(\Theta\).
\(L\) \(m_{TV}+c_Ū\) \(m_\mathrm{TV}(t_\mathrm{TV}- \Theta)=c_\mathrm{L}\)\(m_\mathrm{L}(t_\mathrm{KUŠ}-t_\mathrm{L})+\lambda{m_\mathrm{L}}=c_\mathrm{Ū}\) \(m_\mathrm{L}(\Theta-t_\mathrm{KUŠ})\)
\(m_\mathrm{TV}=\frac{(c_\mathrm{L}m_\mathrm{L}(t_\mathrm{KUŠ}-t_\mathrm{L})+\lambda{m_\mathrm{L}}+c_\mathrm{Ū}m_\mathrm{L}(\Theta-t_\mathrm{KUŠ}))}{(L+c_\mathrm{Ū}(t_\mathrm{TV}-\Theta))}=...\)
\(=0,025 \) \(kg\) |
\(m_\mathrm{TV}\) |
Risinot siltuma bilances uzdevumus, lai labāk saprastu situāciju, notiekošos procesus var aptuveni attēlot grafiski (tikko aplūkotajam piemēram - 2. attēls) (skatīt nodaļu ''Siltuma procesu grafiki''). Procesu norises ilgumiem nav būtiskas nozīmes un tie nav attēloti mērogā.
2.att. Siltuma bilances grafiks