Apkārt esošie ķermeņi sastāv no sīkām daļiņām - atomiem un molekulām. Šīs daļiņas ir tik mazas, ka ar neapbruņotu aci nav saskatāmas, līdz ar to par to eksistenci sākotnēji varēja spriest no netiešiem novērojumiem. Tas bija līdz brīdim, kad pietiekama tehnoloģiju attīstība ļāva atomus un molekulas arī saskatīt (1. att.). Mazākais izmērs, ko ar aci var saskatīt, ir 0,00001 m. Atoms ir aptuveni miljons reižu mazāks, tātad aptuveni 0,0000000001 m jeb 10-10 m (10 nm). Ja mēs iedomātos, ka tāds atoms tiktu palielināts līdz persika izmēram, tad persikam attiecīgi būtu jābūt Zemeslodes izmērā.
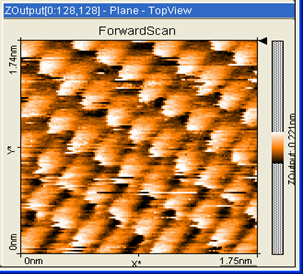
1.att. Grafīta virsmas attēls, kas iegūts ar LU Fizikas un matemātikas fakultātes skenējošo tuneļstrāvas mikroskopu
Viens no atomu un molekulu pastāvēšanas apliecinājumiem bija Brauna kustība, ko 1827. gadā novēroja angļu biologs R. Brauns. Par Brauna kustību sauc šķidrumā vai gāzē izkaisītu daļiņu haotisku un nepārtrauktu kustību (2. att.), ko izraisa vidi veidojošo atomu vai molekulu haotiskā kustība (noskaties video par Brauna kustības attēlojumu). Šāda haotiska kustība pastāv arī cietvielās, ne tikai šķidrumos un gāzēs. Šīs kustības intensitāte ir atkarīga no temperatūras, tādēļ to sauc par siltumkustību.
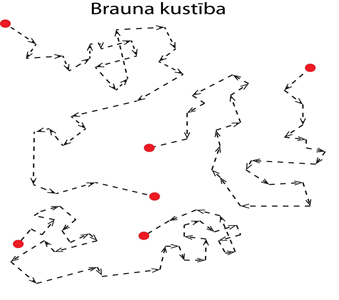
2.att. Brauna kustībai pakļautu daļiņu kustības trajektorijas
Vēl viens process, kas apliecina atomu un molekulu eksistenci, ir difūzija jeb vielu sajaukšanās (skaties video par difūzijas attēlojumu). Ja, piemēram, no rīta karstā ūdenī tiek iemērkts tējas maisiņš (3. att.), tad var redzēt, ka pēc noteikta laika tējas maisiņa saturs ir izplatījies pa visu ūdens tilpumu bez ārējas iejaukšanās. Difūziju veicina atomu un molekulu siltumkustība.

3.att. Difūzijas dēļ notiek dažādu vielu sajaukšanās bez ārēji redzama iemesla
Visātrāk difūzijas process norisinās gāzēs, jo haotiskā siltumkustība tajās ir visaktīvākā. Par to var pārliecināties, apskatot, piemēram, automašīnas izplūdes gāzes: drīz pēc izplūšanas apkārtējā vidē tās strauji izplatās un nonāk gan augstākos, gan zemākos atmosfēras slāņos (4. att.). Arī cietvielās norisinās difūzija, tikai krietni lēnāk nekā gāzēs un šķidrumos, tomēr, palielinot temperatūru un spiedienu, difūzija norit straujāk. Šo faktu izmanto kompozītmateriālu veidošanā, kad dažādi cieti materiāli, pakļauti augstai temperatūrai un spiedienam, difūzijas rezultātā savienojas.

4.att. Izplūdes gāzes difūzijas dēļ ļoti ātri izplatās apkārtējā vidē
Atomiem un molekulām ir ļoti maza masa. Piemēram, vienas ūdens molekulas H20 masa ir aptuveni 3.10-26 kg. Tik mazus lielumus nav ērti izmantot, tādēļ ir ieviesta speciāla mērvienība – atommasas vienība u. Vienas atommasas vienības vērtība ir vienāda ar 1 : 12 daļu no oglekļa izotopa 12C masas (5. att.). Oglekli atommasas noteikšanai izmanto tādēļ, ka tas ir ļoti izplatīts ķīmiskais elements. Ja atommasas vienību izsaka kilogramos, tad iegūst u = 1,6605655 .10-27 kg. Vienas ūdens molekulas masa ir vienāda ar 18 atommasas vienībām.

5.att. Divpadsmit atommasas vienības kopā ir vienādas ar vienu oglekļa izotopa 12C masu
Arī vielas daudzuma mērīšanai ir izvēlēta speciāla mērvienība, jo parasti ir darīšana ar milzīgu vielas daļiņu skaitu. Šajā gadījumā atkal talkā nāk ogleklis. Starptautiskajā mērvienību sistēmā ir pieņemts vielas daudzumu mērīt molos. Viens mols satur daļiņu skaitu, kas vienāds ar 12 gramos oglekļa izotopa 12C esošo daļiņu skaitu. Ļoti svarīgi ir tas, ka mola mērvienībai nav būtiski, ko mēra, galvenais ir vienību skaits. Ir noteikts, ka viens mols satur 6,022045.1023 daļiņas. Šo skaitli sauc par Avogadro skaitli NA. Ar vienu molu viena santīma monētu varētu noklāt Zemeslodi 300 m biezā kārtā (6. att.), līdz ar to ir skaidrs, ka šādu mērvienību ir vērts lietot ļoti mazu objektu skaita mērīšanai.
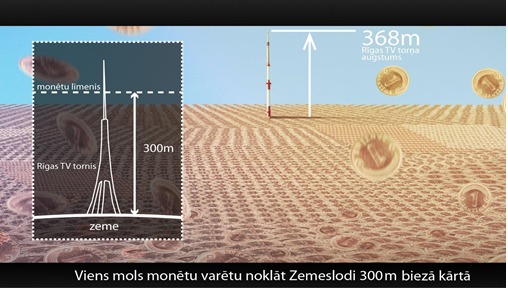
6.att. Viens mols monētu varētu noklāt Zemeslodi biezā kārtā
Lai varētu noteikt, cik sver izvēlētā viela, zinot tās daudzumu molos, ir jāzina šīs vielas viena mola masa, ko sauc par molmasu M. Aprēķinot molmasu, ir jāzina vienas daļiņas masa un Avogadro skaitlis: M = NA . m0, kur m0- vienas daļiņas masa. Tagad, ja ir zināma vielas masa un molmasa, var izrēķināt vielas daudzumu v = m : M, kur v – vielas daudzums, m – vielas masa, bet M – molmasa. Piemēram, dzerot kafiju no vidēja izmēra krūzes, tiek patērēts aptuveni 252 g ūdens. Ūdens molmasa ir Mūdens = 18g/mol. Tādējādi ar vienu kafijas krūzi tiek izdzerts v = m : M = 252 : 18 = 14 mol ūdens jeb 84,28 . 1023(7. att.).

7.att. Viena vidēja kafijas krūze satur ap 14 mol ūdens
Iepriekš uzzinājām, ka viela sastāv no daļiņām – atomiem un molekulām. Bet arī atomiem un molekulām ir sava iekšējā uzbūve. Atomi sastāv no pozitīvi lādēta kodola un negatīvi lādētiem elektroniem, starp kuriem darbojas pievilkšanās spēki. Atomus pieņemts attēlot kā lodītes (8. att a), kuru diametrs atkarīgs no attāluma, kāda elektroni kustas ap kodolu. Molekula sastāv no vairākiem atomiem, vismaz diviem (8. att.), līdz ar to tajā darbojas gan pievilkšanās spēki (starp elektroniem un atomu kodoliem), gan atgrūšanās spēki (starp atomu kodoliem, kā arī starp elektroniem). Rezultējošais kopspēks ir atkarīgs no attāluma starp molekulu veidojošo atomu centriem (8. att. b). Par molekulas diametru pieņemts attālums starp atomu centriem, kad rezultējošais spēks vienāds ar nulli.
unb)attels_1.png)
8.att. Starp molekulu veidojošajiem atomiem darbojas gan pievilkšanās, gan atgrūšanās spēki, kuru summa nosaka kopspēku