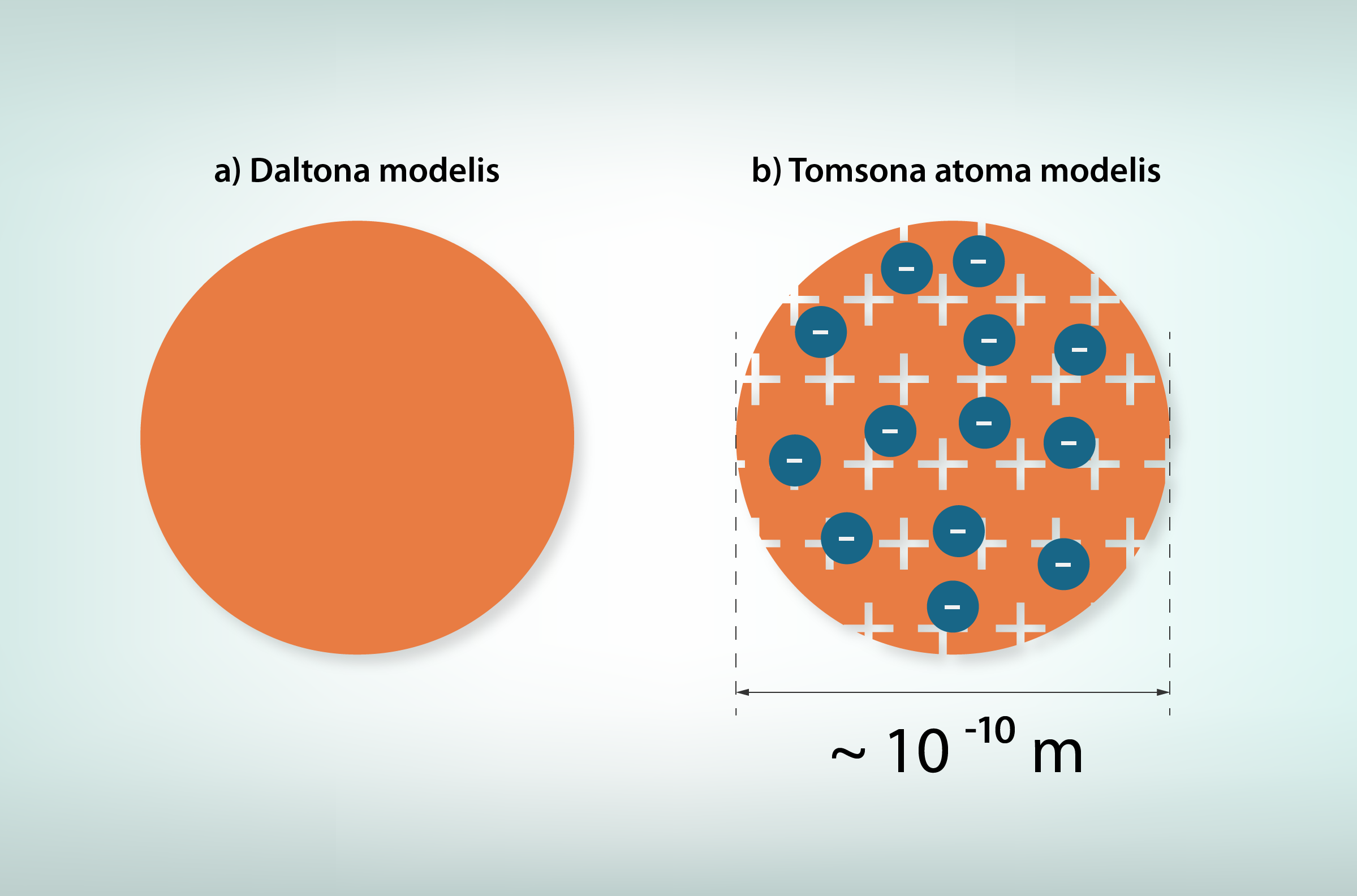
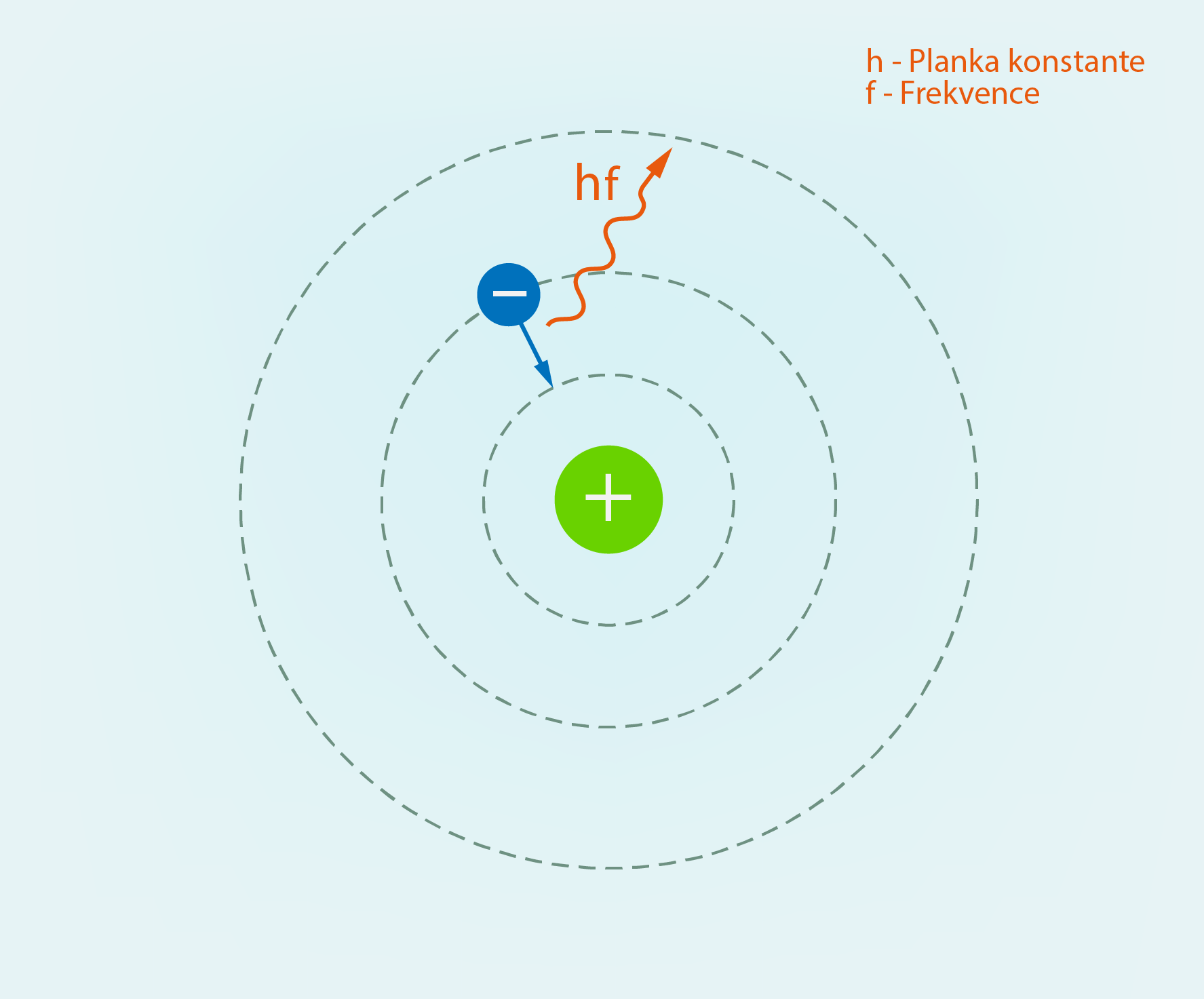
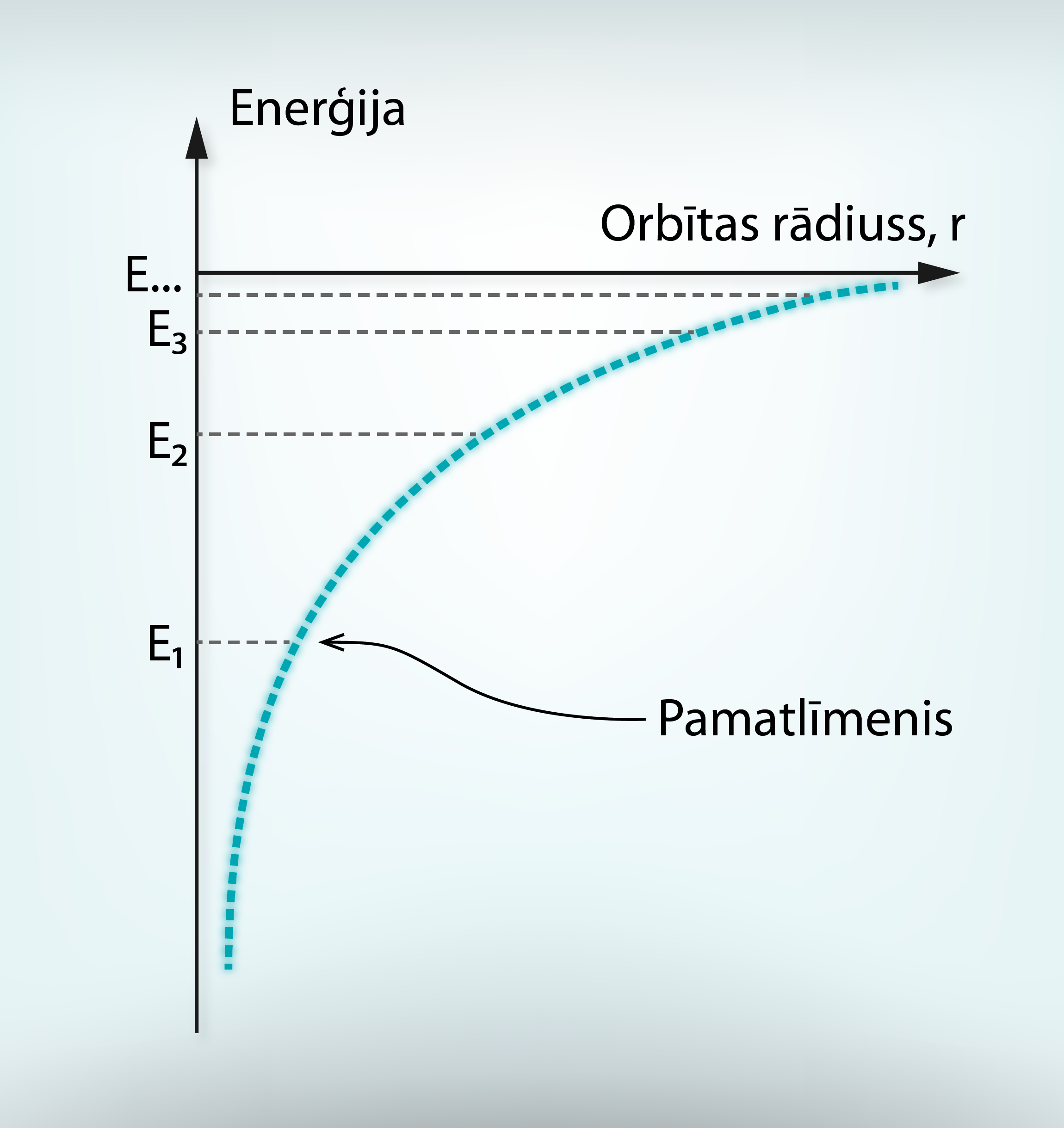
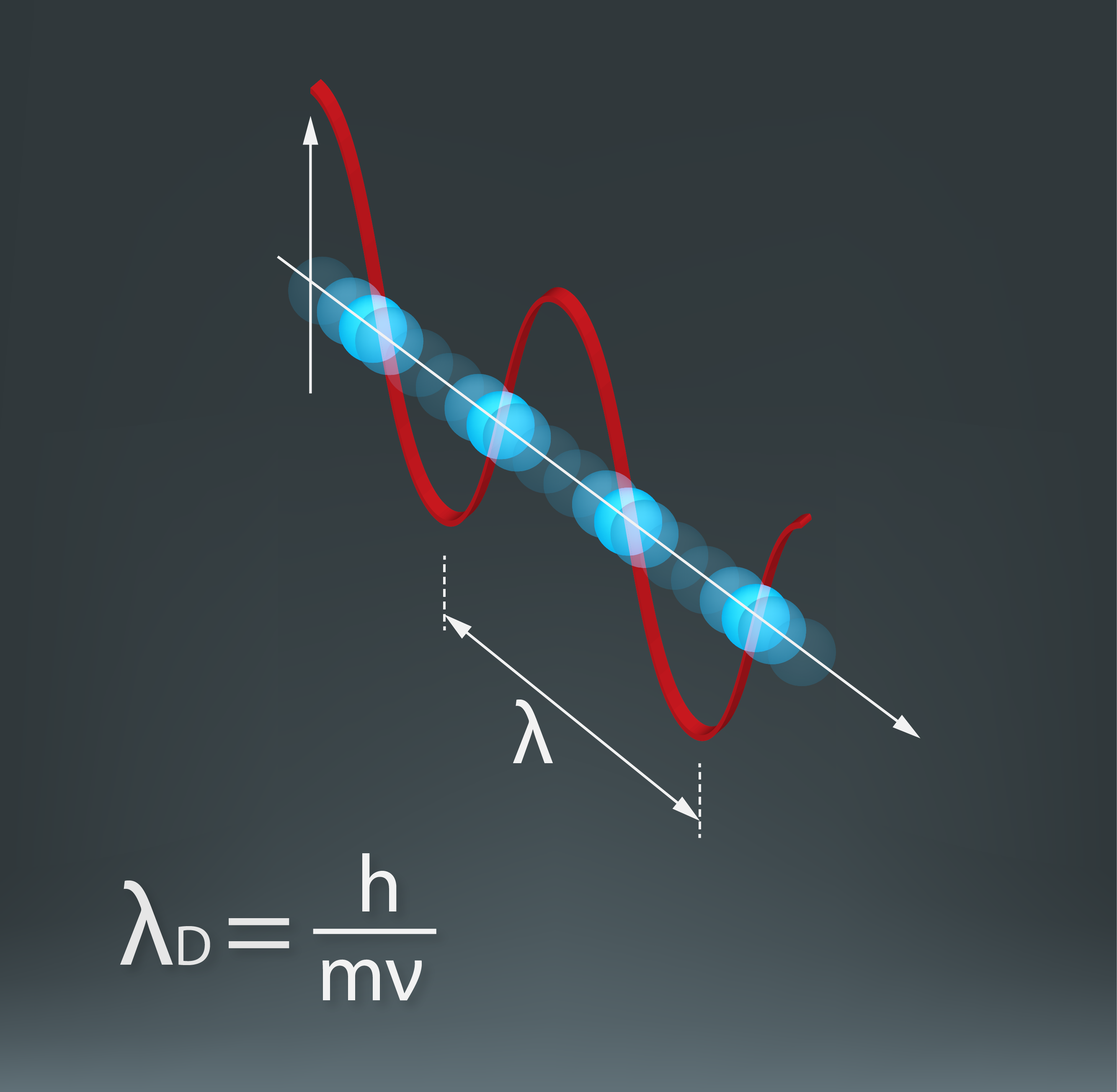
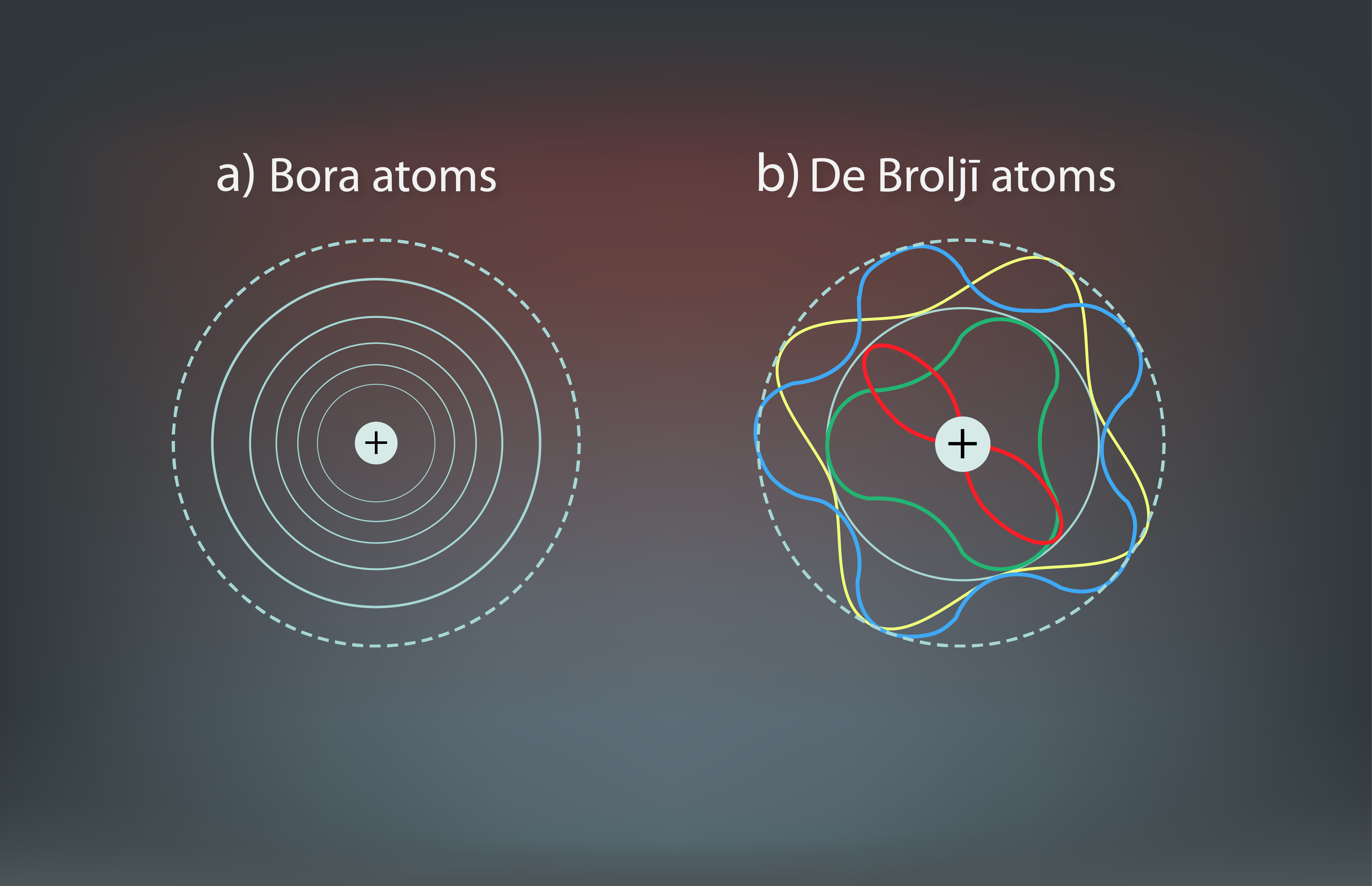
Visa pasaule ir viens liels konstruktors, jo visi ķermeņi ir veidoti no atomiem. Aplūkojot ķīmisko elementu periodisko tabulu, var redzēt, ka dažādo atomu skaits tikai nedaudz pārsniedz simtu, no kuriem dabā sastopami pirmie 92. Atoms sastāv no pozitīvi lādēta kodola, ap kuru atrodas negatīvi lādēts elektronu apvalks (1. att. a). Neitrālā atomā elektronu skaits ir vienāds ar ķīmiskā elementa kārtas numuru Z ķīmisko elementu periodiskajā tabulā (1. att. b). Piemēram, litijam (Li) ir kārtas numurs 3, līdz ar to ap neitrāla Li atoma kodolu atrodas trīs elektroni (1. att.). Viena elektrona lādiņš ir vienāds ar elementārlādiņu e = 1,6 · 10-19C. Līdz ar to kopējais elektronu lādiņš atomam vienāds ar Z · e.
Apskaties DZM materiālu par šo tēmu!
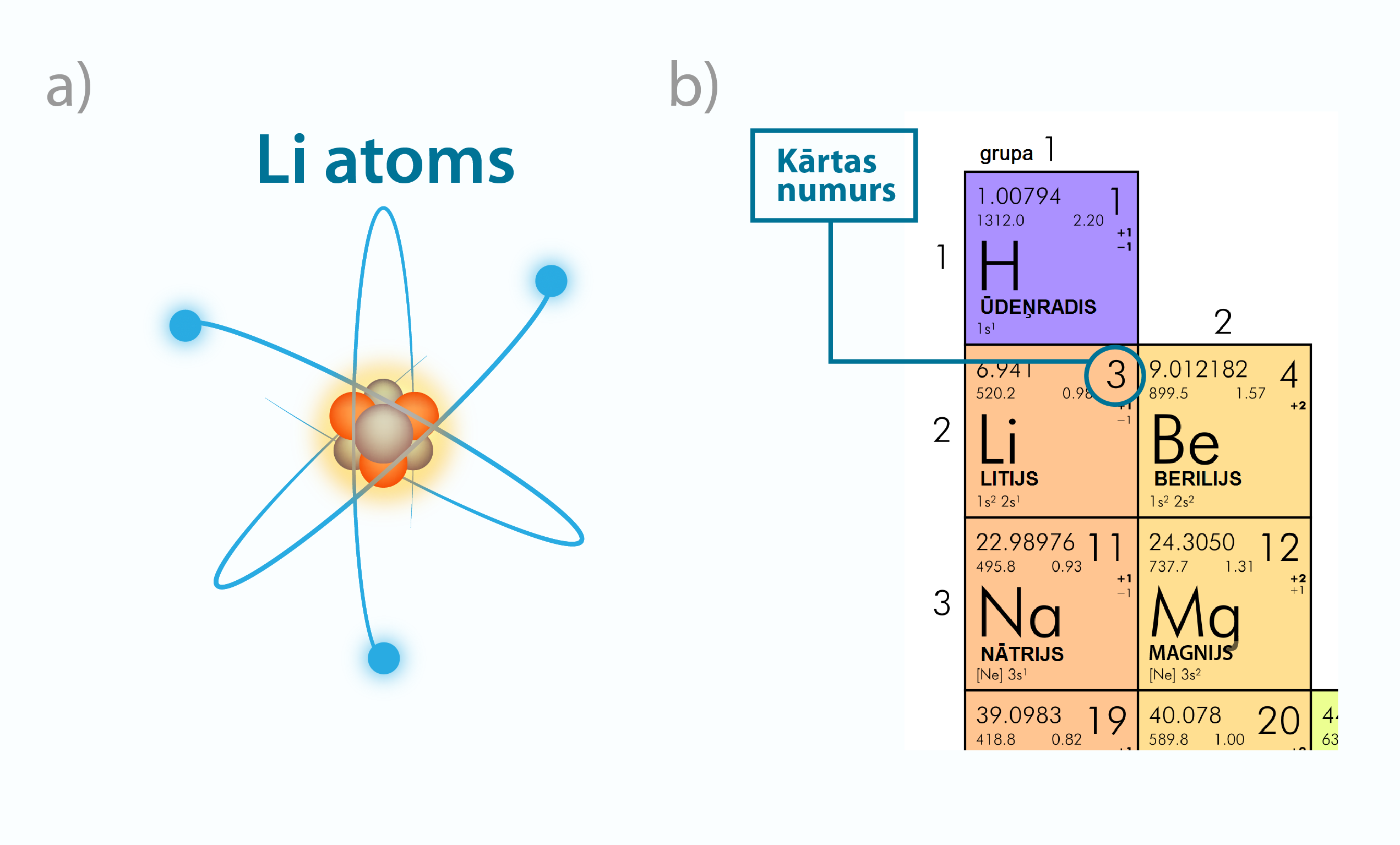
1.att. Atoms un tā raksturlielumi ķīmisko elementu periodiskajā tabulā
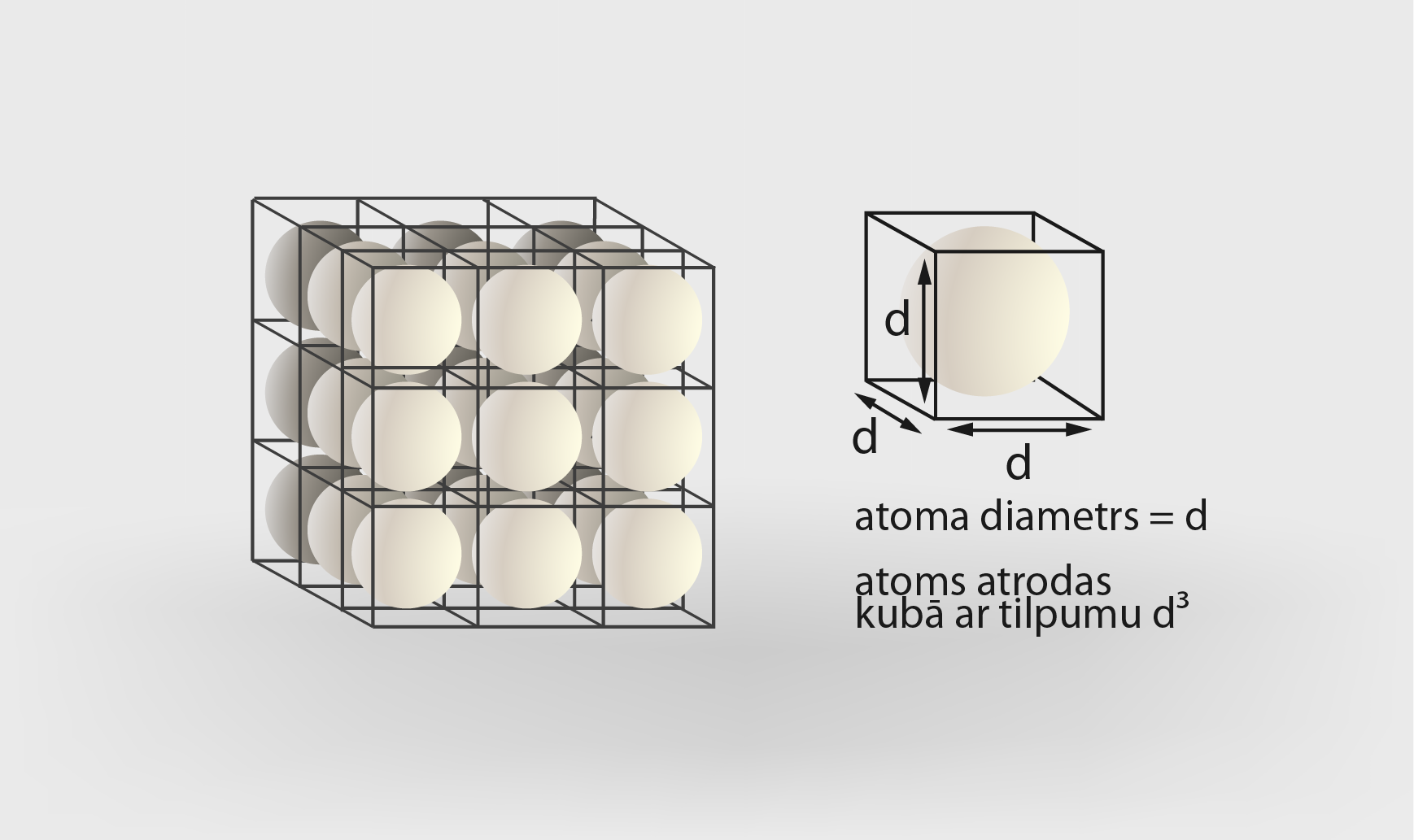
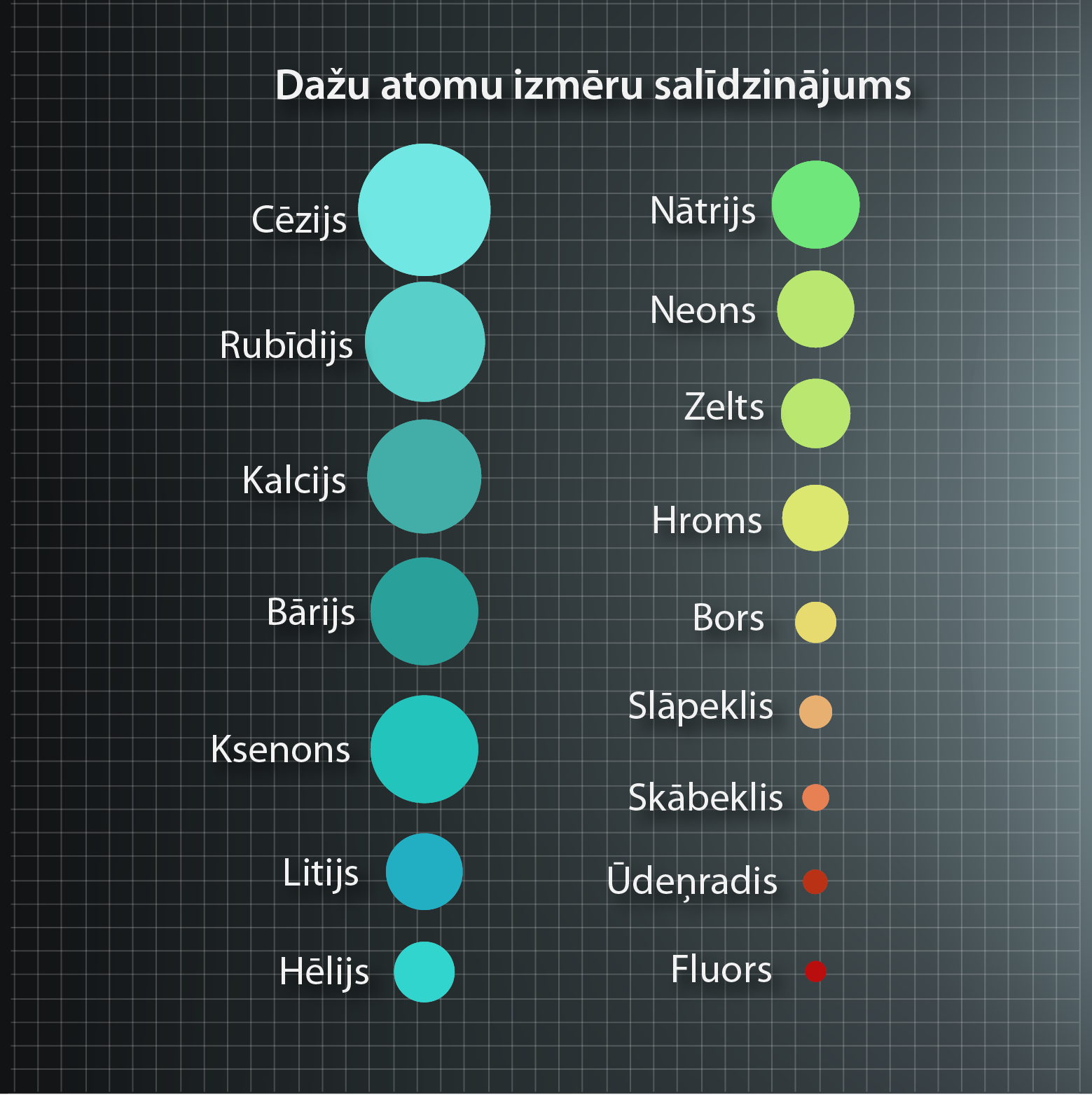
Pozitīvo lādiņu nodrošina protoni, kuru lādiņa lielums ir vienliels ar elektrona lādiņu, tikai ar pretēju zīmi (2. att. a), tādēļ neitrālā atomā protonu un elektronu skaits ir vienāds. Neitroniem lādiņš nepiemīt, tādēļ to skaits neitrālā atomā var būt dažāds. Atoma izmērs ir aptuveni 10-10m, un kodola izmērs ir tikai aptuveni 10-14m (2. att. b). Lai gan kodols ir tik mazs, tajā ir koncentrēta gandrīz visa atoma masa, jo kodols ir veidots no protoniem un neitroniem, kas ir daudz smagāki par elektroniem. Viens protons sver aptuveni tikpat, cik 1836 elektronu (2. att. b). Tas nozīmē: ja elektrons svērtu vienu kilogramu, tad protons svērtu teju divas tonnas. Tajā pašā laikā neitrona un protona masa ir aptuveni vienāda (2. att. c). Lai atoms būtu elektriski neitrāls, kodolam ir jābūt pozitīvi lādētam.
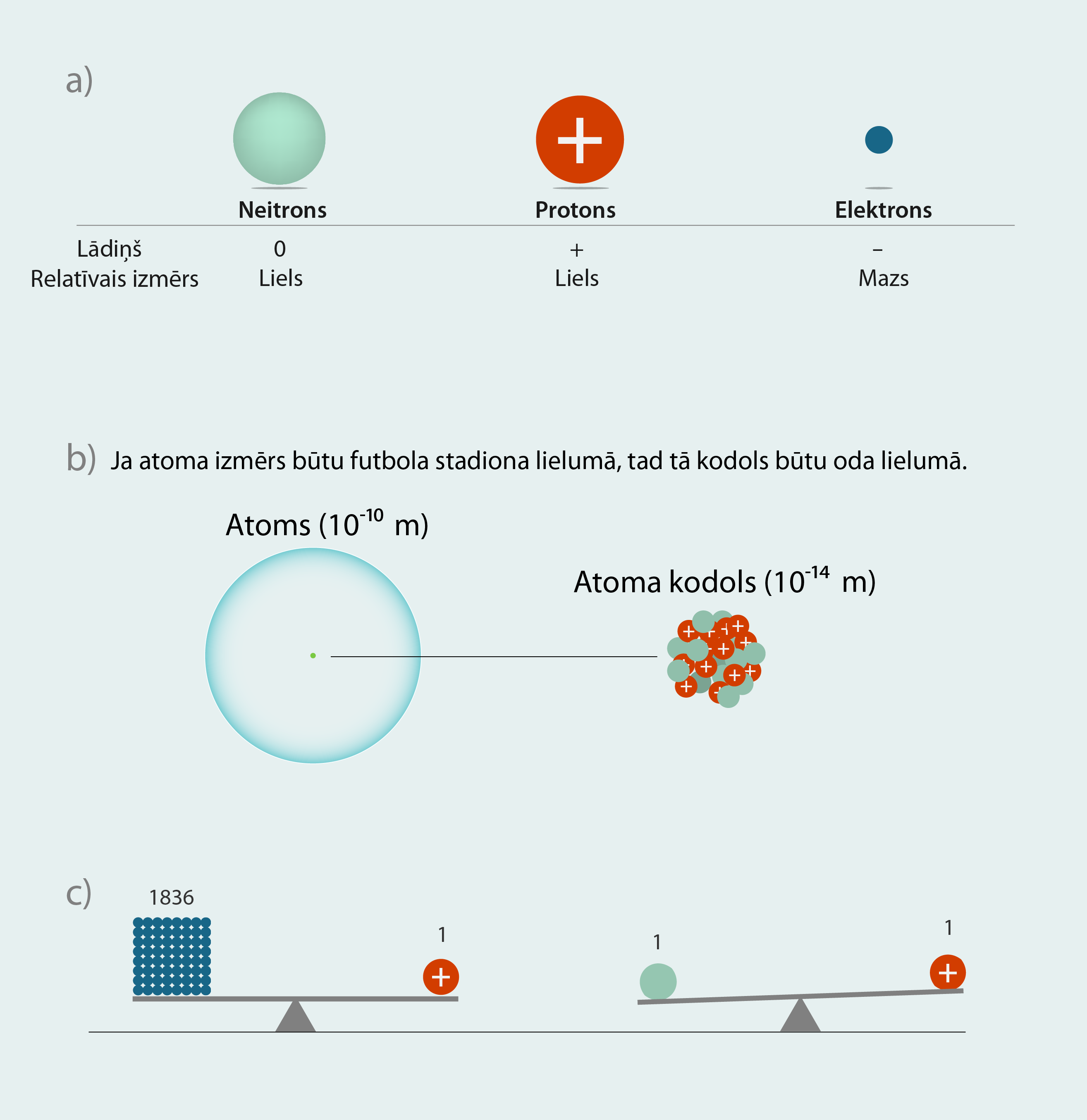
2.att. Atoma uzbūves elementi
Pieaugot ķīmiskā elementa kārtas skaitlim, pieaug kodolā esošo protonu skaits un elektronu daudzums ap to. Ja pirmajam ķīmiskajam elementam – ūdeņradim – ir viens protons un viens elektrons, tad hēlijam jau katra no šīm daļiņām ir pa divi, bet litija atomā atrodas trīs protoni un trīs elektroni (3. att.).
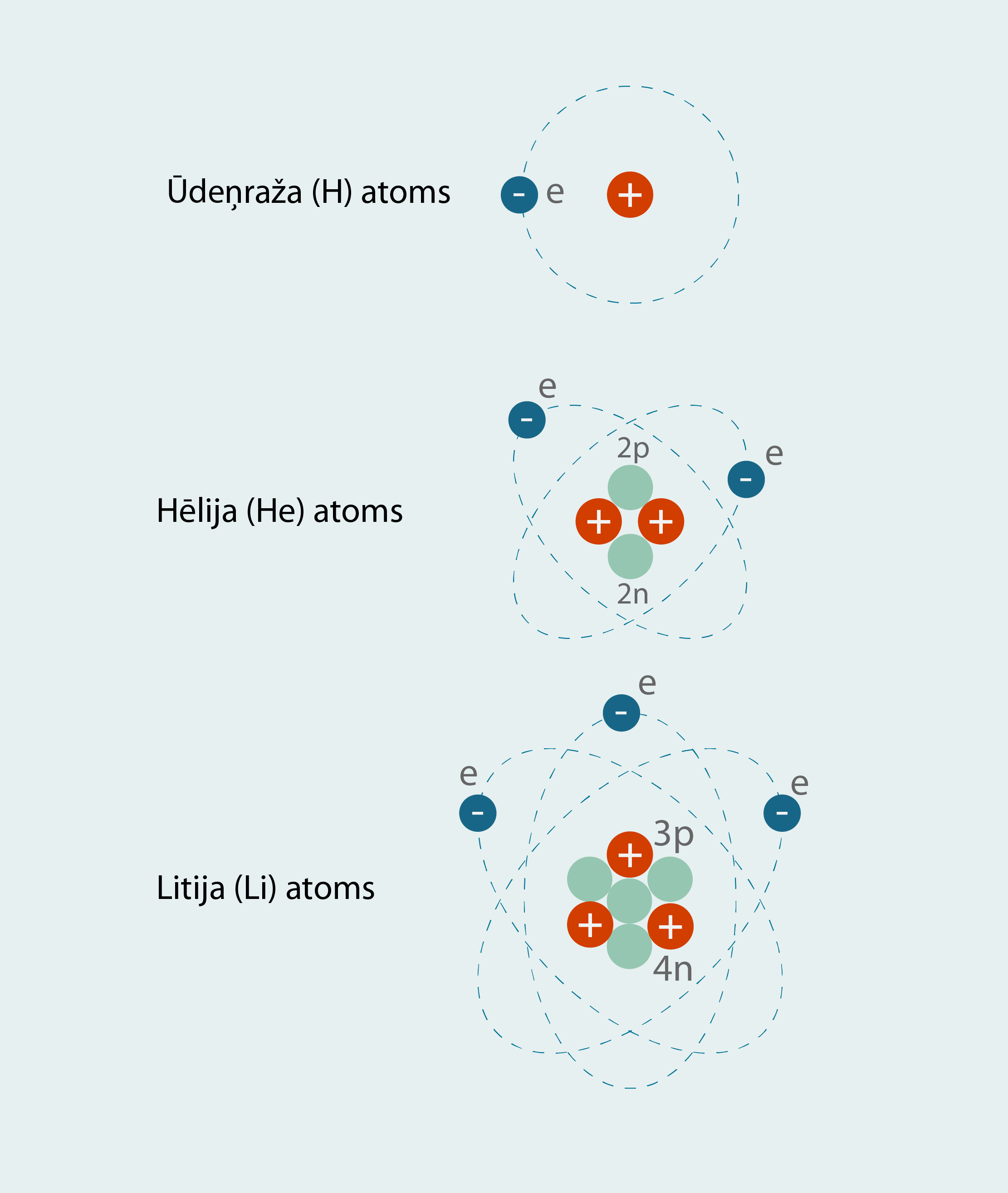
3.att. Atoma uzbūves elementi
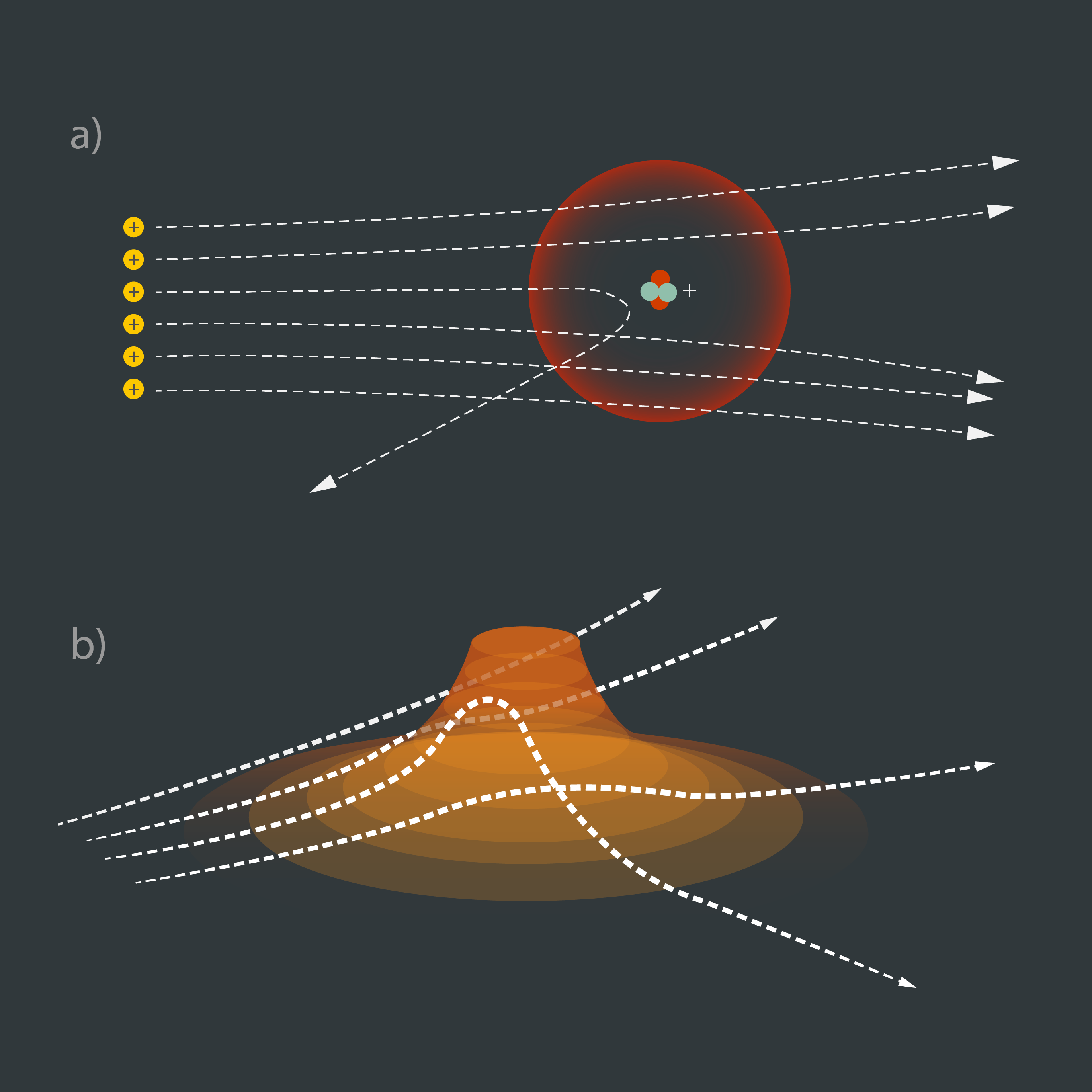
Atoma kodols tika atklāts, apšaudot zelta foliju ar alfa daļiņām un konstatējot, ka dažas alfa daļiņas tiek stipri noliektas un pat atsistas gandrīz pilnībā atpakaļ (Atoma uzbūve); tas liecina par mazu, bet masīvu objektu atoma centrā, kas vēlāk izrādījās atoma kodols. Tikai vēlāk noskaidrojās, ka alfa daļiņas patiesībā ir hēlija atoma kodoli, kas sastāv no diviem protoniem un diviem neitroniem (2. att. a). Hēlijs ķīmisko elementu periodiskajā tabulā atrodas pašā sākumā, tādēļ tā kodolā nav liels nuklonu skaits, taču, pieaugot elementa kārtas skaitlim, nuklonu skaits pakāpeniski pieaug. Tādēļ attēlot, piemēram, urāna kodolu ir daudz grūtāk, jo tajā ir vairāk nekā 200 nuklonu (2. att.).