Iepriekšējā sadaļā noskaidrojām, ka siltums no vienas vietas uz citu var nokļūt vairākos veidos, bet kopīgs ir tas, ka siltumam patīk plūst no siltākas vietas uz aukstāku. Ja divi atšķirīgas temperatūras ķermeņi nonāk kontaktā, tad siltākais ķermenis atdod siltumu, kas ir viens no enerģijas izpausmes veidiem, aukstākajam līdz brīdim, kad abu ķermeņu temperatūras kļūst vienādas. Tad saka, ka ir iestājies termodinamiskais līdzsvars, bet enerģiju, ko siltākais ķermenis ir atdevis vai aukstākais saņēmis, sauc par siltuma daudzumu Q.
1. attēlā redzams, ka telpā ir ienesta glāze ar karstu ūdeni, kura temperatūra ir augstāka nekā telpas temperatūra, līdz ar to siltums no glāzes izplūst apkārtējā telpā. Tas notiks līdz brīdim, kad telpas un glāzes temperatūras kļūs vienādas.
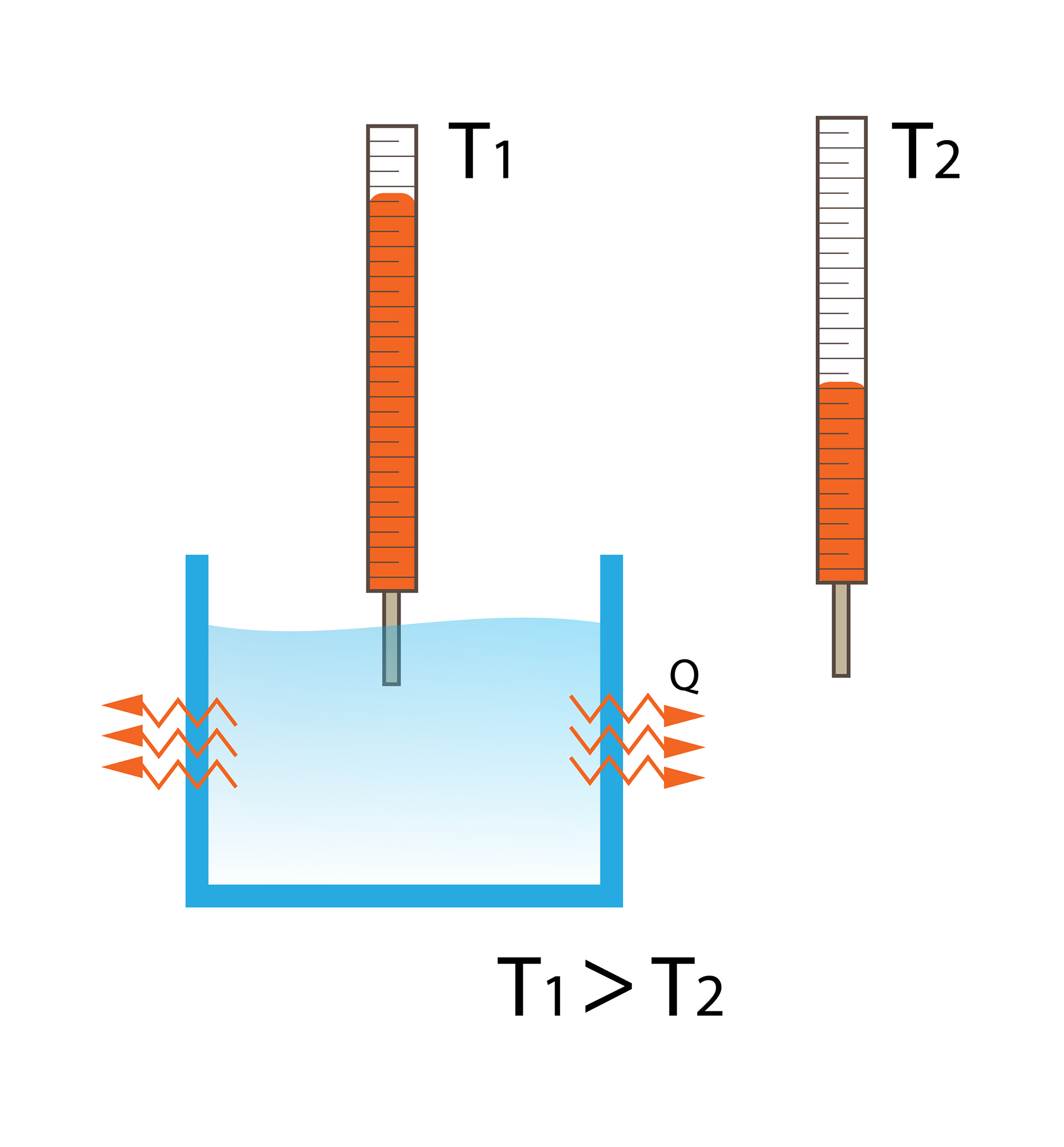
1.att. Siltums no karstās glāzes izplūst apkārtējā telpā
Ja mēs kādam ķermenim piešķiram siltuma daudzumu Q, tad paaugstinās ķermeņa temperatūra. Tomēr dažādiem ķermeņiem temperatūra pieaug dažādi, piemēram, ja vienādos apstākļos silda 1 kg ūdens un 1 kg spirta (2. att.), tad spirtam temperatūra pieaug straujāk. Tas ir tādēļ, ka spirtam ir mazāka īpatnējā siltumietilpība.
Par īpatnējo siltumietilpību c sauc siltuma daudzumu, kas jāpievada vienam kilogramam vielas, lai tā temperatūru paaugstinātu par vienu Kelvina vai Celsija grādu (Kelvina un Celsija grādi ir vienlieli), c mērvienība ir J:(kg. oC)vaiJ:(kg.K).
Izmēģini animāciju par siltumietilpību!
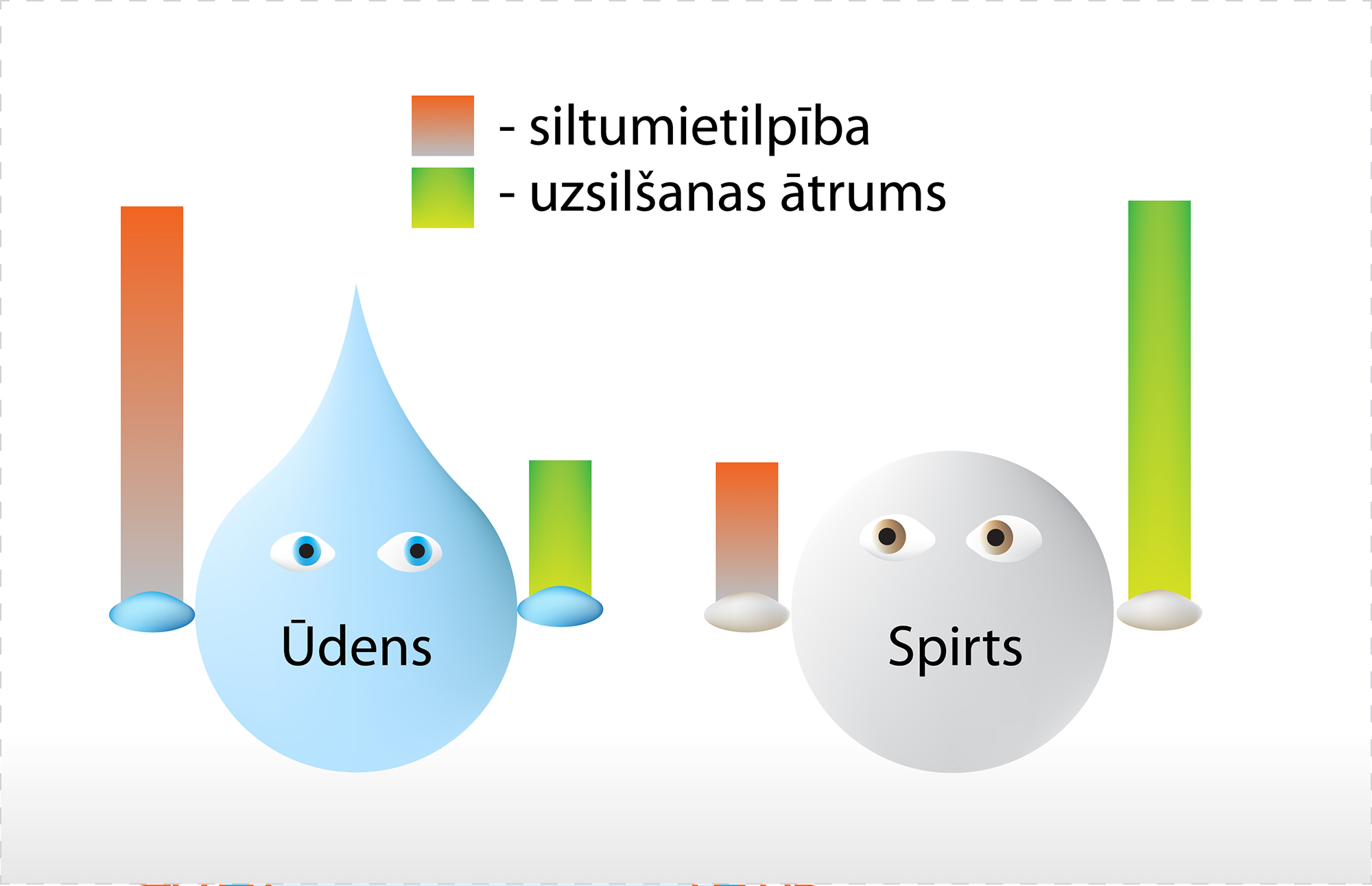
2.att. Ūdenim un spirtam ir atšķirīga siltumietilpība
Ja ķermenis, kura masa ir m, ir veidots no materiāla, kura siltumietilpība ir c, tad ķermeņa atdoto vai saņemto siltuma daudzumu var aprēķināt pēc formulas Q = cm(T2-T1) = cmΔT,kur T2 – beigu temperatūra, bet T1 – sākuma temperatūra. Šeit tiek izmantota temperatūru starpība, tādēļ var lietot Celsija grādus. Piemēram, ūdenim ir ļoti augsta siltumietilpība cūdenim = 4200 J : (kg .0C), līdz ar to, lai 1 kg ūdeni uzsildītu par 1 0C grādu, nepieciešami 4200J enerģijas (3. att.).
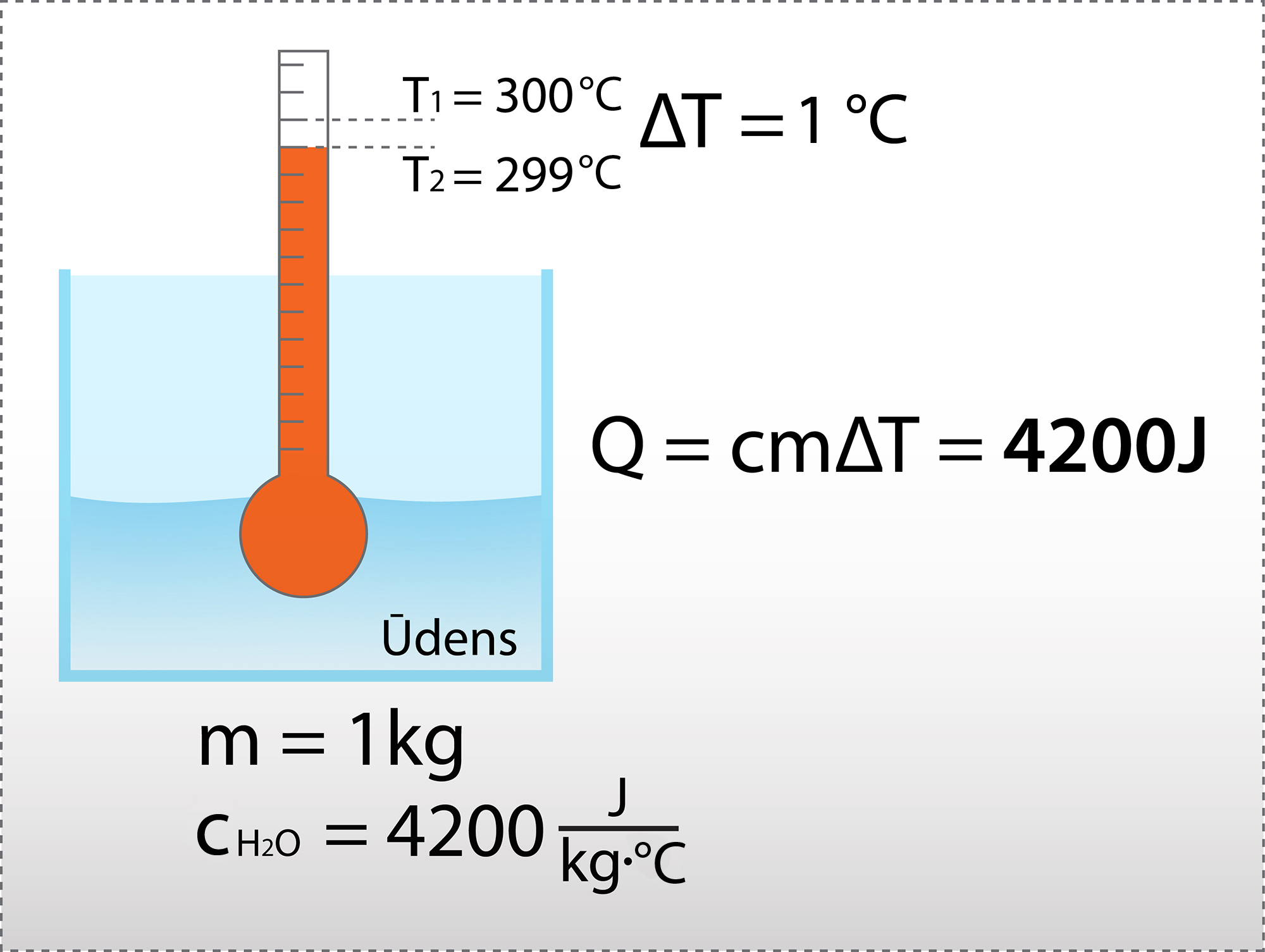
3.att. 1kg ūdens uzsildīšanai nepieciešamā enerģija
Ja to pašu ūdeni vāra katliņā uz plīts, tad var novērot, ka līdz vārīšanās temperatūrai tas uzsilst ātri (4. att. a), bet pēc tam ūdens katliņā vēl ilgi burbuļo un burbuļo, līdz pavisam iztvaiko. Tas nozīmē, ka ūdens iztvaikošanai (4. att. b) ir nepieciešama liela enerģija. Šo enerģiju, kas nepieciešama viena kilograma ūdens vai jebkura cita šķidruma iztvaicēšanai, sauc par īpatnējo iztvaikošanas siltumu, apzīmē ar L un mēra J/kg. Lai aprēķinātu siltuma daudzumu, kas nepieciešams vielas iztvaicēšanai, lieto formulu Q = L.m, kur m ir vielas masa.

4.att. Ūdens uzsildīšanai (a) ir nepieciešams mazāks enerģijas daudzums nekā ūdens iztvaicēšanai (b)
Līdzīgi ir ar kādas cietas vielas izkausēšanu, arī šim procesam ir vajadzīga liela enerģija, šajā gadījumā lieto īpatnējo kušanas siltumu, ko apzīmē ar λ un arī mēra J/kg. Lai aprēķinātu kausēšanai nepieciešamo siltuma daudzumu, lieto izteiksmi Q = λm. Ja procesi notiek pretējā virzienā, proti, viela nevis iztvaiko vai kūst, bet gan kondensējas vai sacietē, tad siltums tiek izdalīts, nevis patērēts. Siltums izdalās arī tad, kad tiek sadedzināts kāds kurināmais. Šādā gadījumā lieto kurināmā īpatnējo sadegšanas siltumu q, kura mērvienības ir J/kg. Izvēloties kurināmā veidu, ir ļoti svarīgi zināt šo īpatnējo sadegšanas siltumu, lai zinātu, cik daudz siltuma varēs iegūt no viena kg kurināmā (5. att.), tomēr svarīgi ir arī citi faktori, piemēram, cik lielu piesārņojumu rada attiecīgā kurināmā izmantošana.

5. att. Dažādu kurināmo īpatnējais sadegšanas siltums
Dažādām vielām siltumietilpība var krasi atšķirties, kā tas redzams 1. attēlā. Kārtējo reizi rekordistu vidū ir ūdens, un tas ir vēl viens pierādījums ūdens unikālajām īpašībām, kas ir bijis noteicošais faktors, lai uz Zemes rastos dzīvība, kas spēj pastāvēt vēl šobaltdien.

1.att. Dažādu vielu siltumietilpība
Ar ūdens lielo siltumietilpību saskaras cilvēki, kas dzīvo pie jūras. Vasarā ūdens ļoti daudz siltuma uzkrāj, tādēļ pie jūras vasarā ir aukstāks nekā dziļāk kontinentā. Savukārt ziemas ir siltākas, jo ziemā ūdens uzkrāto enerģija daudzumu atdod. Ikdienišķāk siltumietilpības spēku var sajust mākoņainās vasaras dienās. Apkārtējam gaisam ir maza siltumietilpība, līdz ar to, kad spīd Saule, mums ir silti, savukārt tiklīdz Saule beidz spīdēt, mums diezgan ātri kļūst vēsi, jo gaiss ir uzkrājis maz siltuma enerģijas.
Ja apskatām īpatnējo iztvaikošanas siltumu dažādiem šķidrumiem (2. att), tad arī šajā gadījumā ūdens ir izteikts līderis.
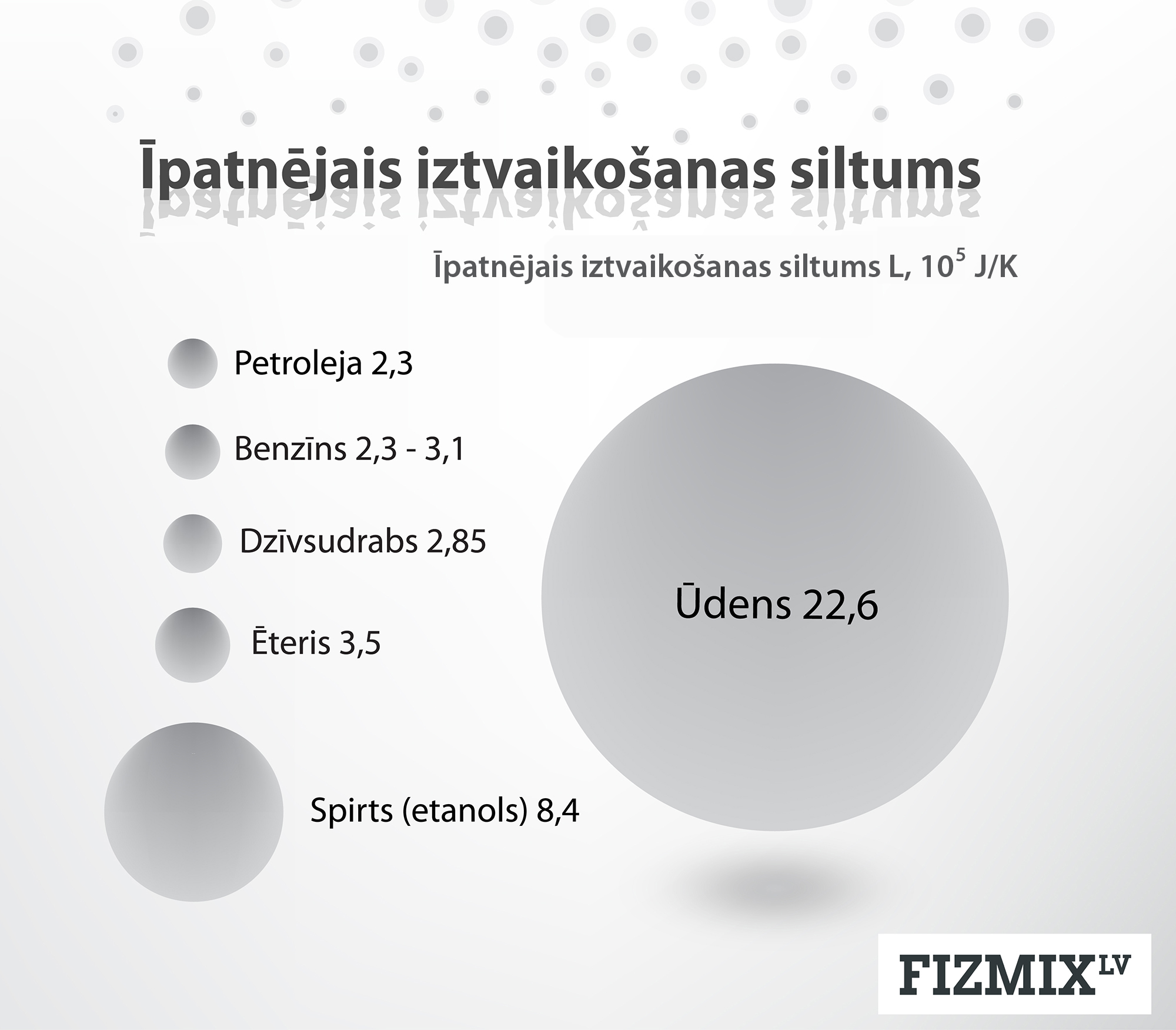
2.att. Dažādu šķidrumu īpatnējais iztvaikošanas siltums
Ar ūdens īpatnējo iztvaikošanas siltumu mēs saskaramies brīžos, kad dažādu iemeslu dēļ saslapināmies (3. att.) un saprotam, ka slapjš ķermenis ātrāk sajūt vēsumu. Tas ir tādēļ, ka uz ādas esošais ūdens sāk iztvaikot un iztvaikošanai nepieciešamais siltums tiek paņemts no organisma.

3.att. Slapjš ķermenis atdod vairāk siltuma
Atkarībā no temperatūras viela var būt cietā, šķidrā vai gāzveida agregātstāvoklī. Tas nozīmē, ka mēs varam paņemt kādu cietu vielu un, pievadot tai siltumu, vērot, kā šī viela mainās. 4. attēlā redzama cietas vielas karsēšana. Tā vispirms sasniedz kušanas temperatūru un izkūst. Turpinot pievadīt siltumu, šķidrumā esošo daļiņu ātrums palielinās, līdz tiek sasniegta iztvaikošanas temperatūra, un, ja sildīšanas netiek pārtraukta, tad viela pārvēršas gāzveida stāvoklī.
Izmēģini fāžu pārejas animāciju!
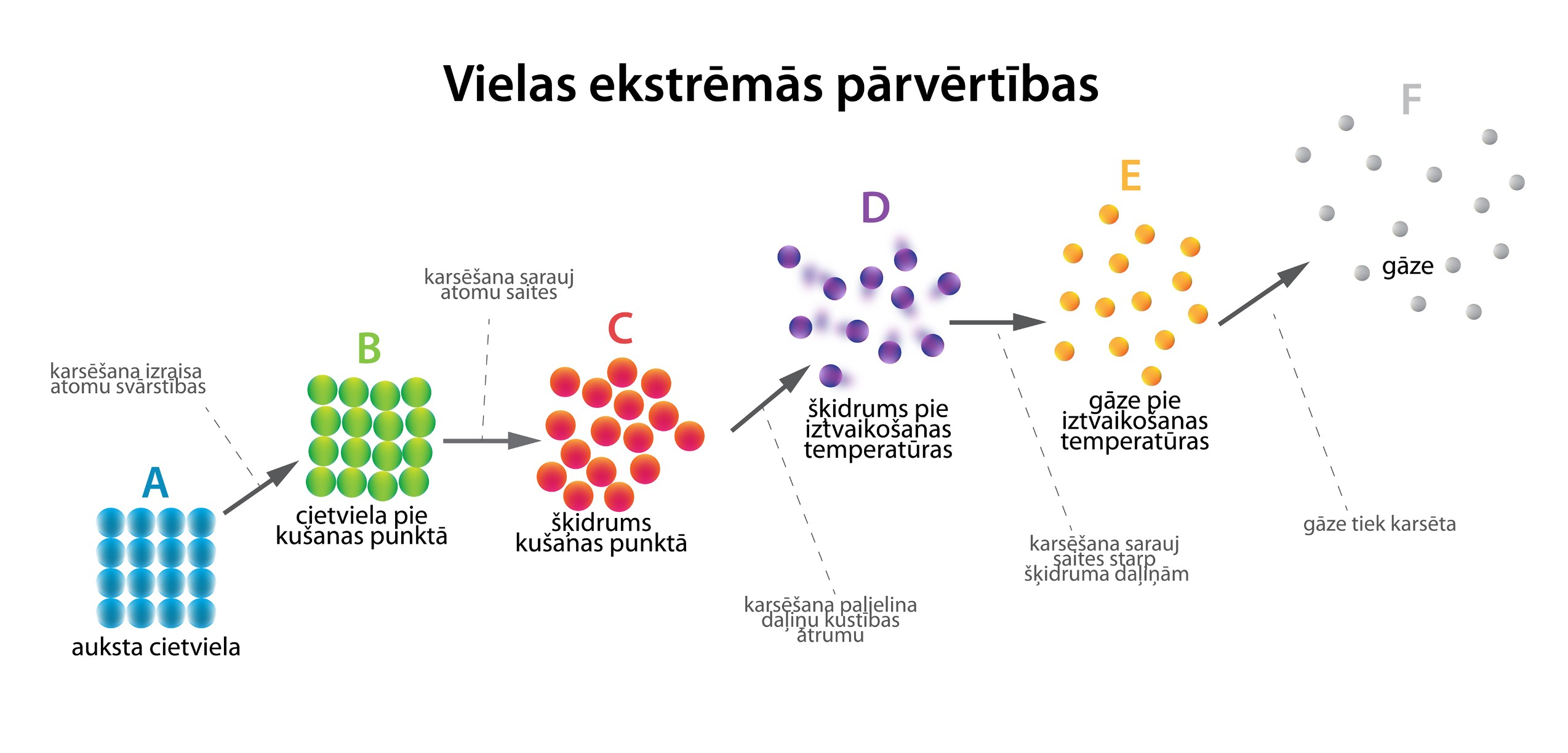
4.att. Vielu ekstrēmās pārvērtības
4. attēlā apskatītajam procesam var uzzīmēt grafiku temperatūras atkarībai no siltuma pievadīšanas ilguma (5. att.). Grafikā redzams, ka ir divi laika momenti, kuros temperatūra nemainās. Tie atbilst kušanas un iztvaikošanas procesam, kurus raksturo energoietilpīga saišu saraušanas starp vielas daļiņām. Slīpie grafika posmi atbilst vielas sildīšanai dažādos agregātstāvokļos. Grafika slīpums ir atkarīgs no vielas siltumietilpības konkrētajā agregātstāvoklī.
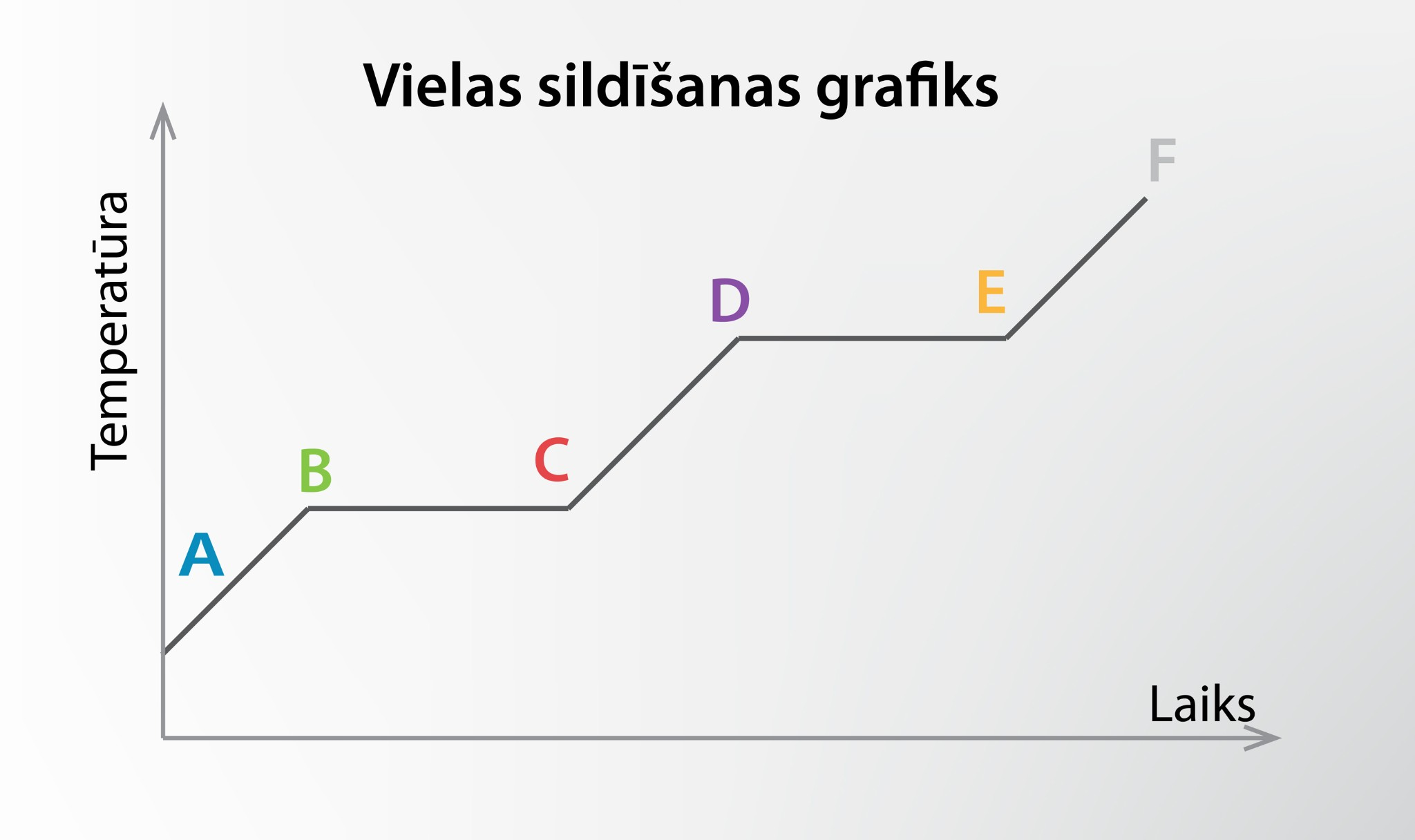
5.att. Vielas sildīšanas grafiks
Iepriekšējos soļos noskaidrojām, ka vielu var raksturot ar īpatnējo siltumietilpību, kas norāda, cik daudz siltuma jāpievada, lai 1 kg vielas uzsildītu par vienu grādu. Jāuzmanās ar gāzu īpatnējo siltumietilpību, jo izrādās, ka vienai un tai pašai gāzei siltumietilpība izohoriskā un izobāriskā procesā ir atšķirīga (1. att.), proti, izobāriskā procesā gāzi raksturo lielāka siltumietilpība.
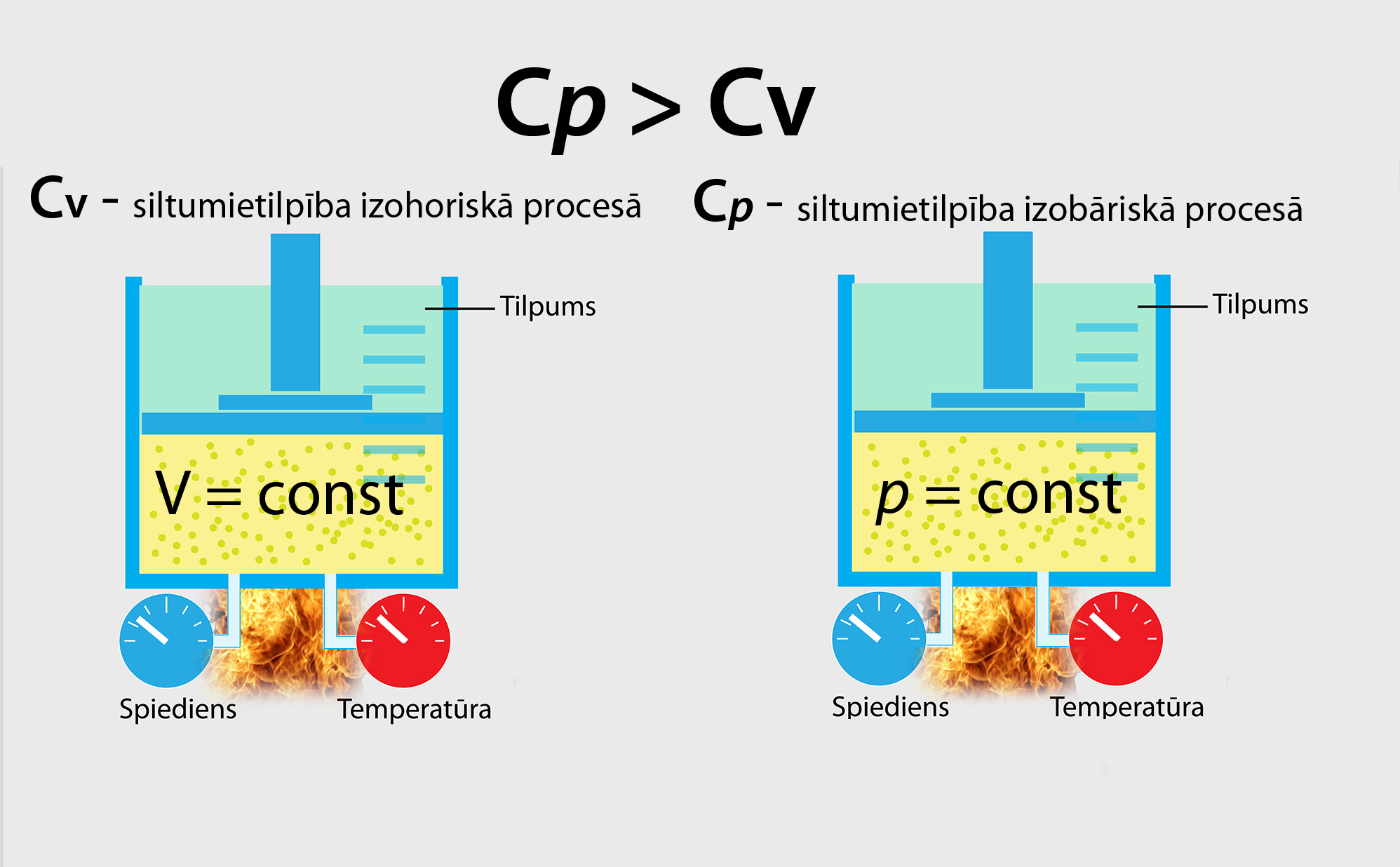
1.att. Gāzes siltumietilpības salīdzinājums dažādos procesos
Siltuma daudzuma SI mērvienība ir tāda pati kā enerģijai un darbam – džouli (J). Tomēr sadzīvē tiek lietota vēl viena mērvienība – kalorija (cal). Viena kalorija ir 4,19 J jeb 1J = 0,24 cal. Kalorijas izmanto, piemēram, lai uz pārtikas produktiem norādītu to enerģētisko vērtību. Piemēram, ja enerģijas batoniņš satur 115 kcal enerģijas, tas ir vienāds ar aptuveni 0,48 MJ enerģijas. Ar to pietiek, lai metra augstumā paceltu 48 t smagu kravu (2. att.)
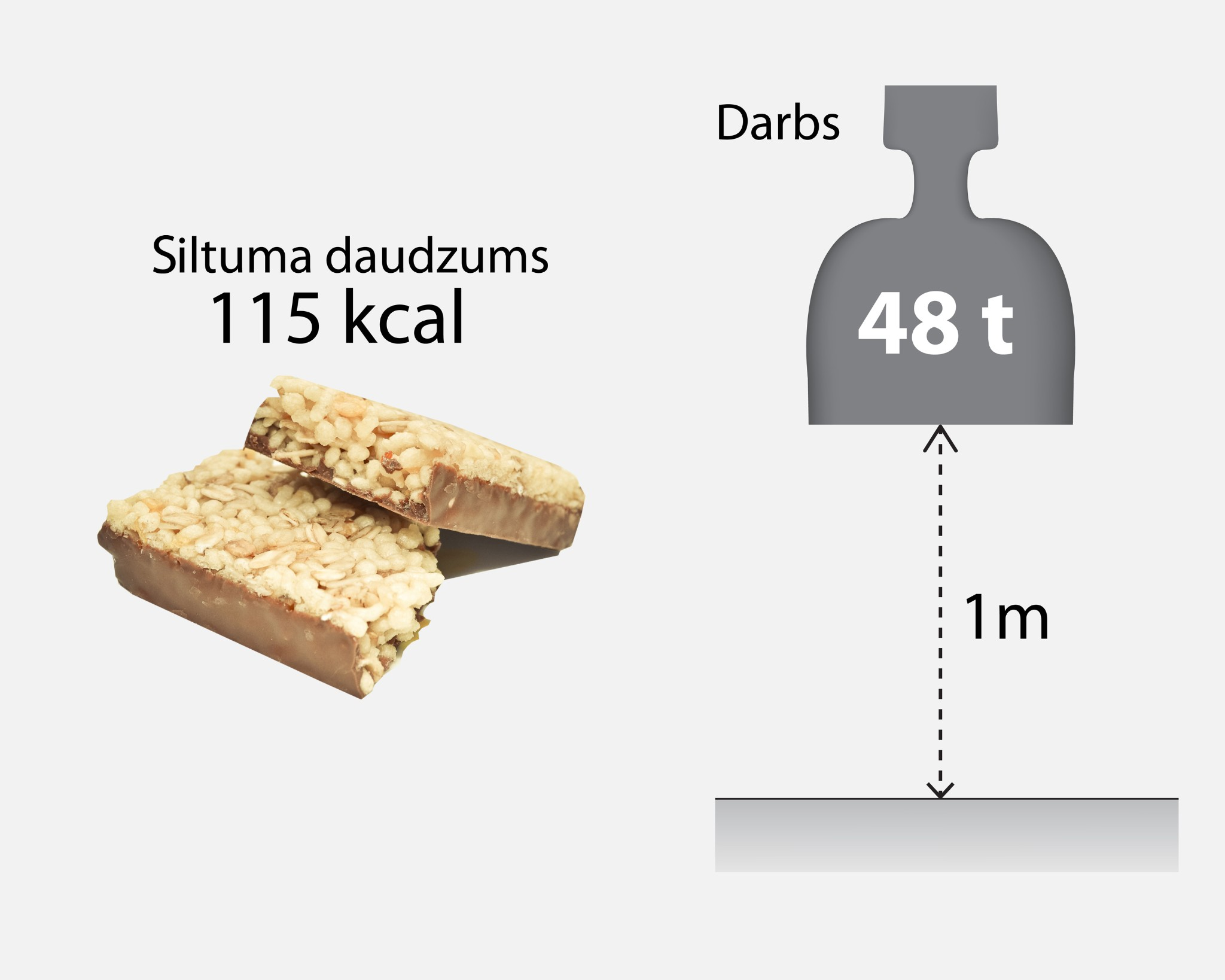
2.att. Enerģijas batoniņā noslēptā enerģija