Metālos strāvu vada brīvie elektroni. Ja metāls neatrodas elektriskajā laukā (1. att. a), tad elektroni ir pakļauti tikai haotiskai siltumkustībai. Ja metālu pakļauj elektriskajam laukam E (sk. 1. att. b), elektroni papildus haotiskajai kustībai šī lauka ietekmē piedalās virzes kustībā, un metālā plūst strāva. Kustoties caur metāla kristālrežģi, elektroni saduras ar to veidojošajām daļiņām, un rezultātā metālā rodas elektriskā pretestība R. Cilindriskam metāla vadītājam (1. att.) elektrisko pretestību rēķina pēc formulas R = ρl : S, kur
ρ - vielas īpatnējā elektriskā pretestība (Ω·m),
l - vadītāja garums (m),
S - vadītājā šķērsgriezuma laukums (m2).
Metālu elektriskā pretestība ir atkarīga no temperatūras. Ja 0oC temperatūra metāla vadītāja pretestība ir R0, tad temperatūrā t tā ir R = R0(1+α), kur α ir pretestības termiskais koeficients.
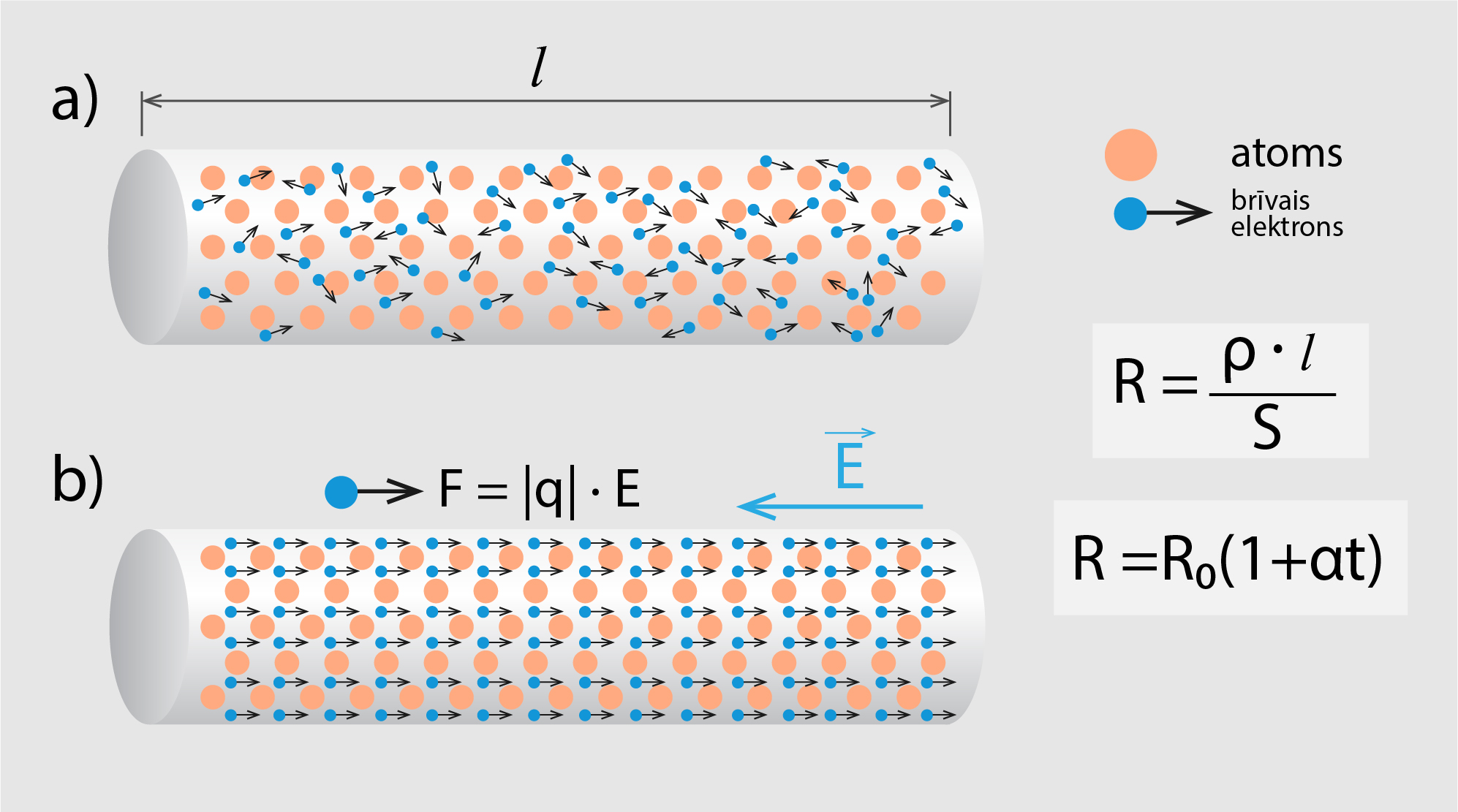
1.att. Elektriskā strāva metālos
Šķidrums var būt gan dielektriķis, gan vadītājs atkarībā no tā, vai šajā šķidrumā veidojas joni, kas var vadīt elektrisko strāvu. Ja kāds ķīmiskais savienojums šķidrumā veido jonus, tad šo vielu sauc par elektrolītu. Ja traukā ar ūdenī izšķīdina, piemēram, vara sulfātu (CuSO4), tad šīs molekulas disociē (sadalās) pozitīvos Cu2+ un negatīvos SO42- jonos. Ja šajā šķīdumā ievieto katodu un anodu un pieslēdz tos strāvai, tad Cu2+ pārvietojas katoda virzienā, bet SO42- joni anoda virzienā, un tā rezultātā šķīdumā plūst strāva I (2. att.). Cu2+ jons, nonākot uz katoda, saņem divus elektronus un kļūst par neitrālu vara atomu. Šī procesa rezultātā uz katoda laika gaitā nogulsnējas viela ar masu m. Vielas masu var izrēķināt, izmantojot formulu m = kq, kur
k - vielas elektroķīmiskais ekvivalents (kg/C),
q - caur šķīdumu izplūdušā lādiņa lielums C.
Vielas elektroķīmiskais ekvivalents norāda to, cik liela vielas masa kilogramos izdalās uz elektroda, jau caur šķīdumu izplūst vienu kulonu liels lādiņš.
Lādiņu q var izteikt no strāvas stipruma definīcijas, iegūstot q = It, kur I ir strāvas stiprums ampēros, bet t ir strāvas plūšanas ilgums sekundēs. Ievietojot šo iepriekš apskatītajā izteiksmē, iegūst m = kIt.
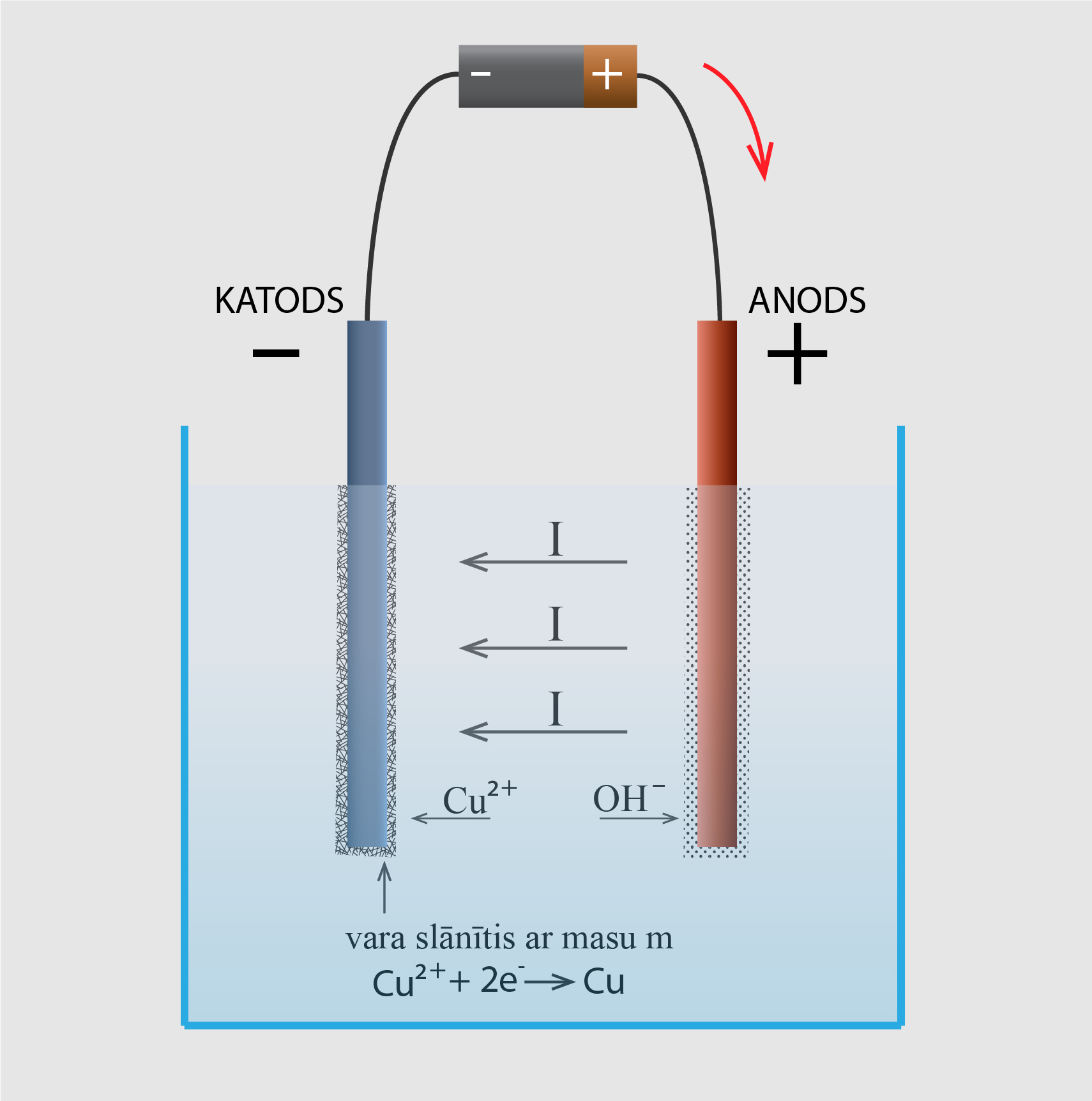
2.att. Elektriskā strāva elektrolītos
Atšķirībā no metāliem šķīdumos temperatūras pieauguma rezultātā elektriskā pretestība samazinās. Tas ir tādēļ, ka, pieaugot temperatūrai, šķīdumā pieaug jonu skaits, kas var vadīt elektrisko strāvu.
Skaties DZM materiālu par elektrisko strāvu dažādās vidēs!
Metālos kristālrežģi veido joni jeb atomi, kas zaudējuši vienu vai vairākus elektronus. Šie elektroni kļūst par brīvajiem elektroniem metālā, kuri nodrošina metālu labo elektrovadītspēju. Atkarībā no temperatūras joni kristālrežģī svārstās kādā amplitūdā A1 un ik pa laikam aizšķērso ceļu elektroniem, veicinot sadursmes ar tiem. Šīs sadursmes nosaka elektronu trajektorijas līkloču formu (1. att. a). Ja metāla temperatūra pieaug līdz T2, tad pieaug arī jonu svārstību amplitūda, kas tagad ir A2. Šādā gadījumā svārstošies joni biežāk aizšķērso ceļu elektroniem, tādēļ elektronu trajektorijas kļūst komplicētākas (1. att.) un pieaug metāla elektriskā pretestība.
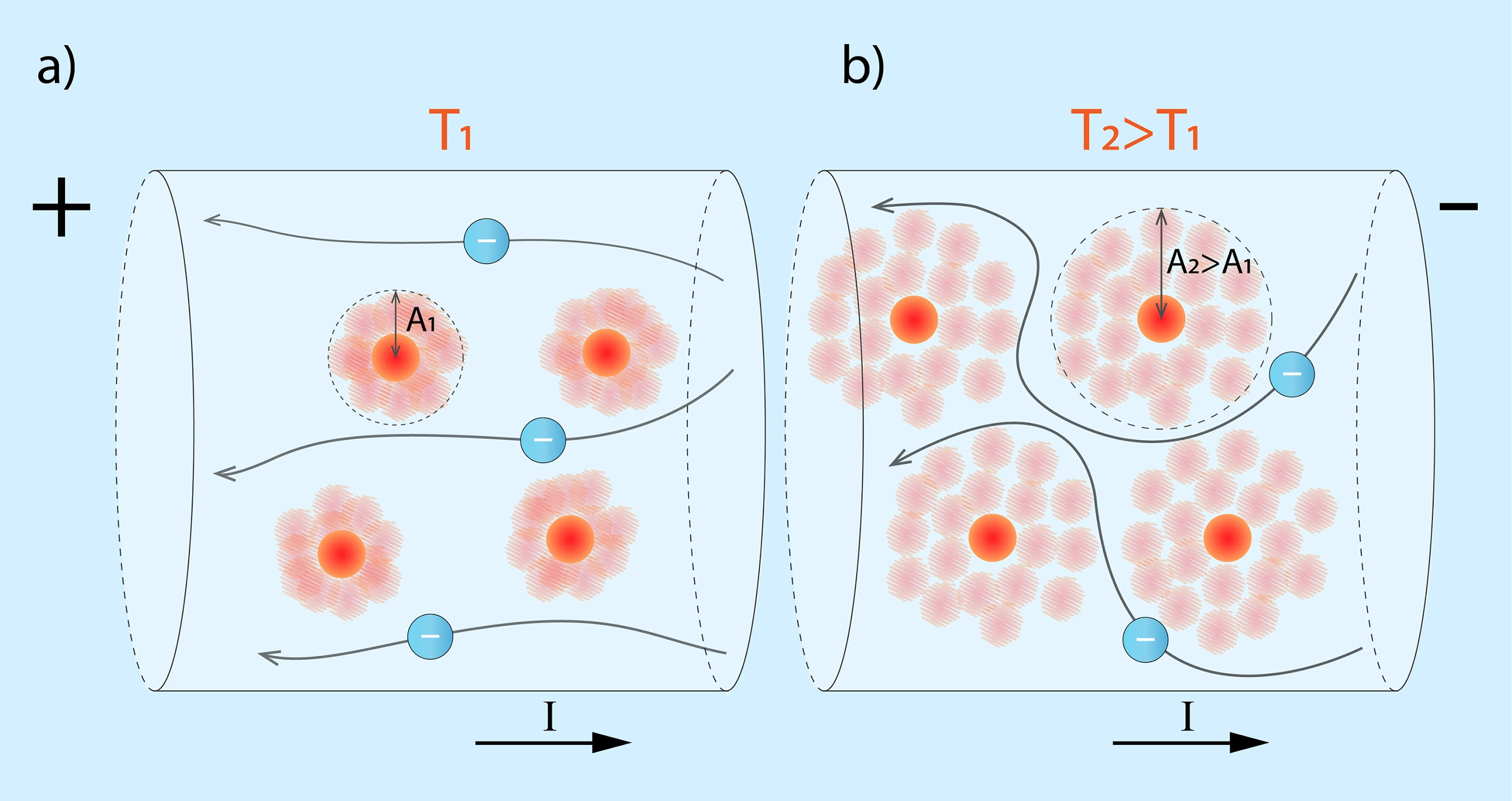
1.att. Elektronu kustība metālā pie dažādām temperatūrām
Ja metālā temperatūra samazinās, samazinās kristālrežģa jonu svārstību amplitūda un līdz ar to arī elektriskā pretestība. Ja temperatūra kļūtu vienāda ar absolūto nulli jeb 0 K, tad jonu svārstību kustība pilnīgi apstātos. Tādā gadījumā elektronu kustība vairs netiktu traucēta un elektriskajai pretestībai vajadzētu būt nullei. Taču, pētot metālu pretestību pie zemām temperatūrām, ir atklājies, ka pretestība tomēr nesasniedz nulli, bet nokrīt līdz vērtībai Rd (2. att. a). Tas ir tādēļ, ka kristālrežģī ir dažādi defekti (2. att. b) un elektroni saduras ar šiem defektiem.
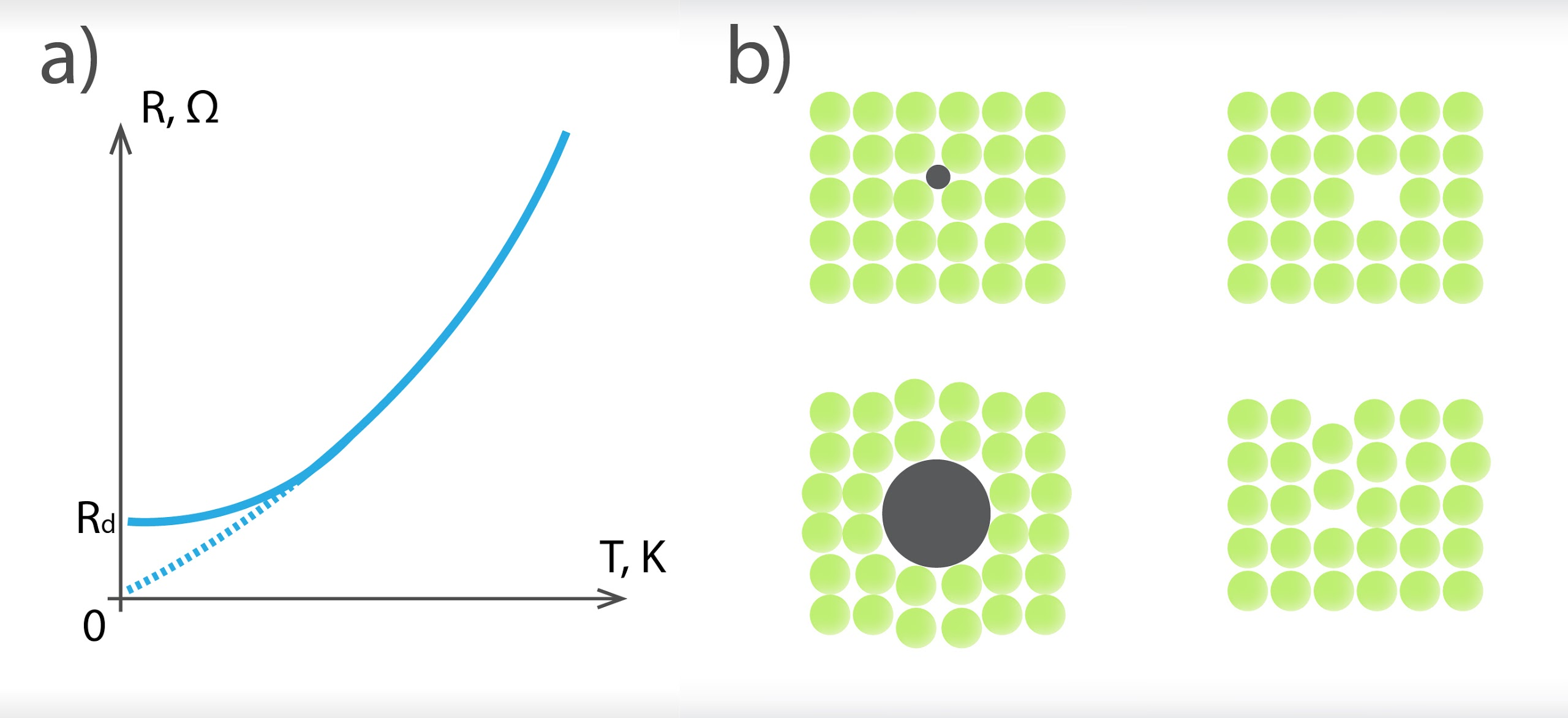
2.att. Metālu pretestības atkarība no temperatūras un defektu pretestības
Metālu elektriskās pretestības atkarību no temperatūras izsaka formula R = R0(1 +α), kur
R – pretestība (Ω),
R0– pretestība pie 0 ⁰C (Ω),
t – temperatūra ⁰C,
α – pretestības termiskais koeficients (1/K).
Atšķirību starp dažādu metālu pretestības izmaiņām temperatūras ietekmē izsaka pretestības termiskais koeficients α. Jo lielāks ir šis koeficients, jo straujāk pieaug vadītāja pretestība temperatūras ietekmē. Dažādas α vērtības apskatāmas 3. attēlā.
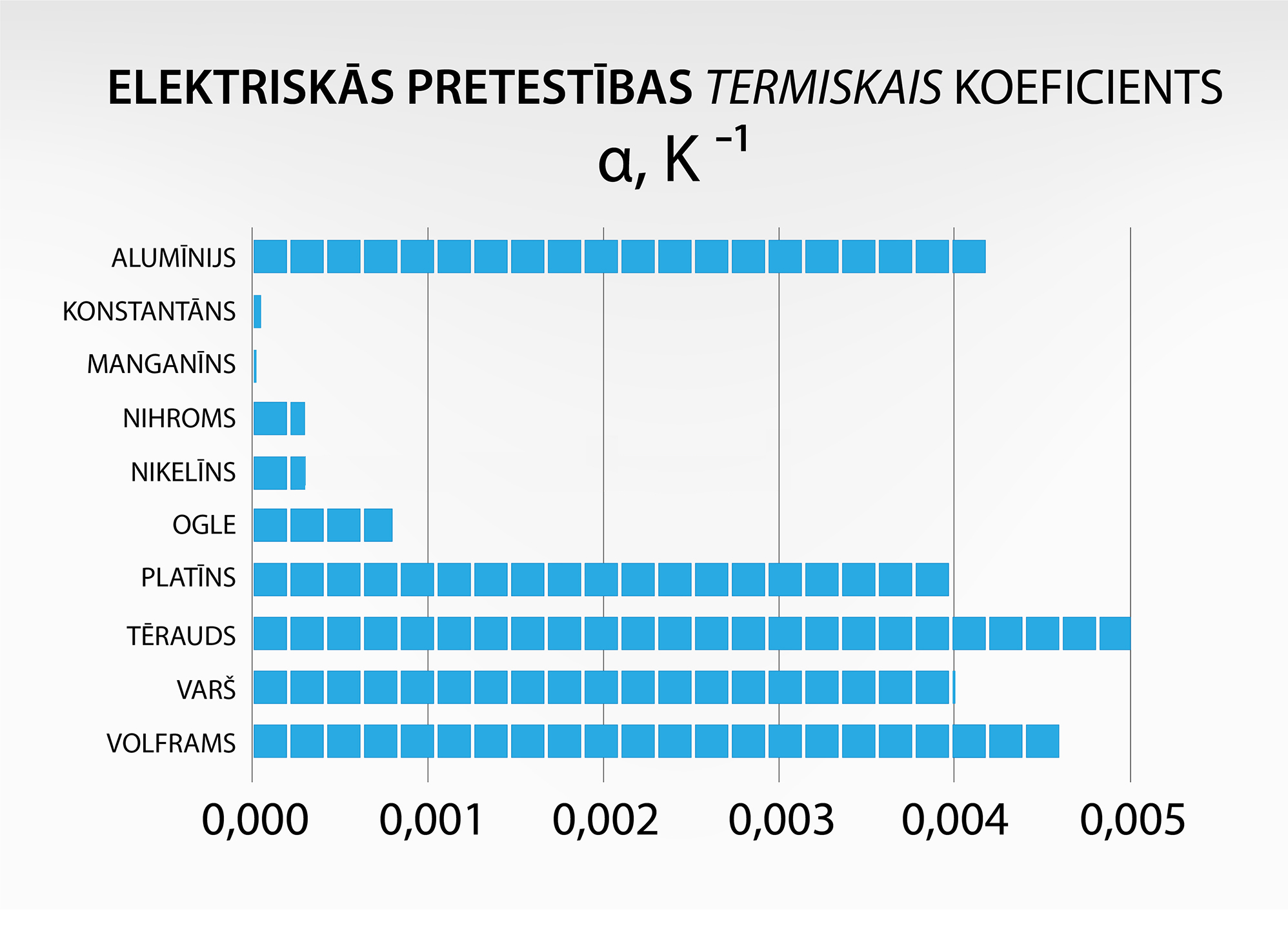
3.att. Vielu elektriskās pretestības termiskais koeficients
Lai šķidrums vadītu elektrisko strāvu, tajā ir jābūt joniem, kas vada elektrisko strāvu. Viens veids, kā nodrošināt jonu klātbūtni šķidrumā, ir ievietot tajā vielu, kas šķidrumā disociē jeb sadalās jonos, veidojot elektrolītu. Elektrolīts ir viela, kura šķīdumos disociē jonos. Ja ūdenī ievieto H2SO4 molekulas, tad ūdens molekulu dipoli nostājas ap šo molekulu (4. att. a), tādā veidā ar savu elektrisko lauku samazinot pievilkšanos starp sērskābes pozitīvi lādēto H+ daļu un negatīvi lādēto SO4-2. Šī disociācijas procesa rezultātā H2SO4 sadalās jonos (4. att. b).
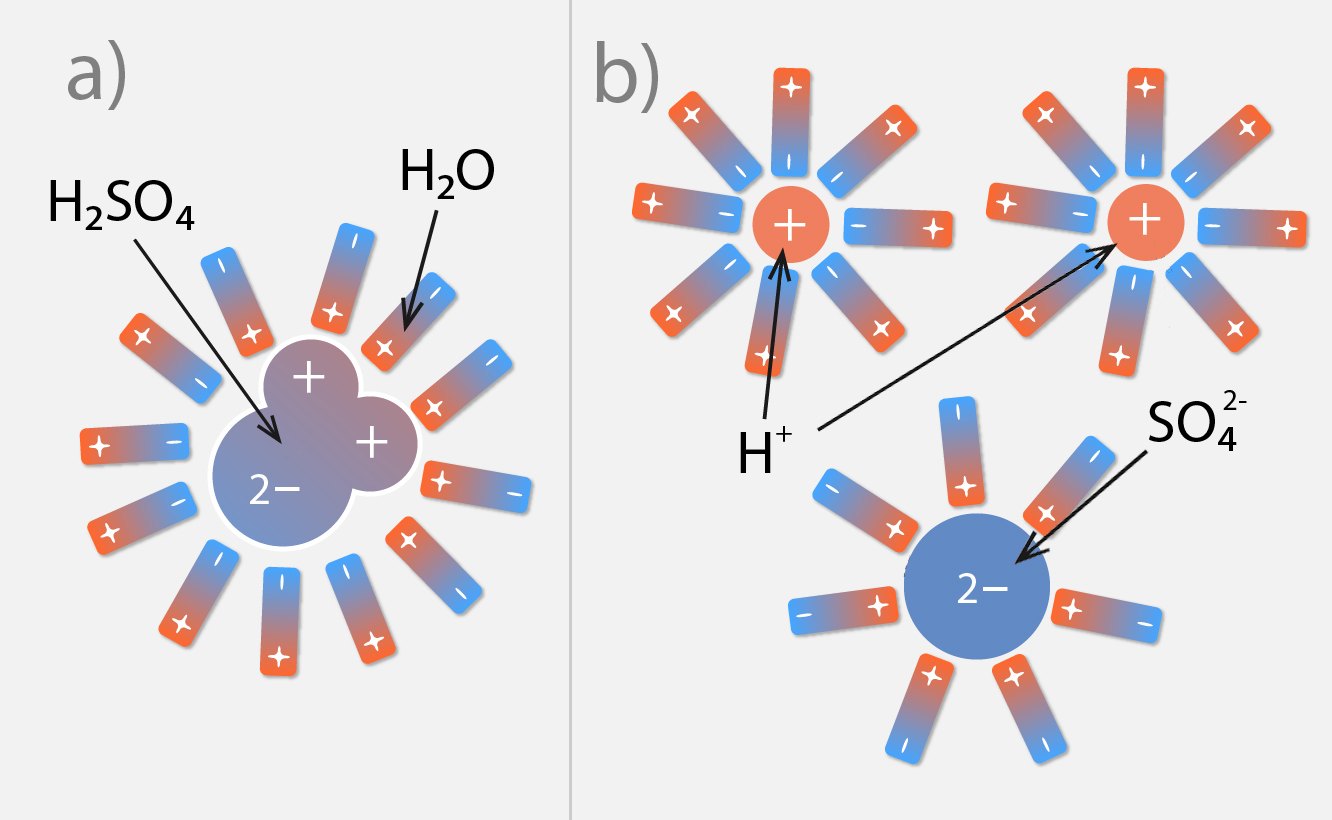
4.att. Vielas disociācija ūdenī
Tātad, ja ūdenī ievieto CuSO4, tad ūdens molekulas nodrošina šī vielas disociāciju Cu2+ un SO42- jonos (5. att.). Paralēli disociācijai notiek arī pretējs process, proti, Cu2+ un SO42- joni apvienojas CuSO4 molekulās. To sauc par rekombināciju. Šķīdumā disociācijas un rekombinācijas procesi norit reizē, un pienāk brīdis, kad laika vienībā disociējošo molekulu skaits ir vienāds ar rekombinējošo molekulu skaitu. Tad starp procesiem ir iestājies dinamisks līdzsvars, un jonu skaits šķīdumā nemainās. Ja šķīdumā ievieto elektrodus un pieslēdz tos spriegumam, tad caur šķīdumu sāk plūst strāva, kā rezultātā uz katoda laika gaitā nogulsnējas viela ar masu m. Šo procesu sauc par elektrolīzi. 5. attēlā aplūkotajā gadījumā elektrolīzes rezultātā uz katoda izgulsnēsies varš Cu.
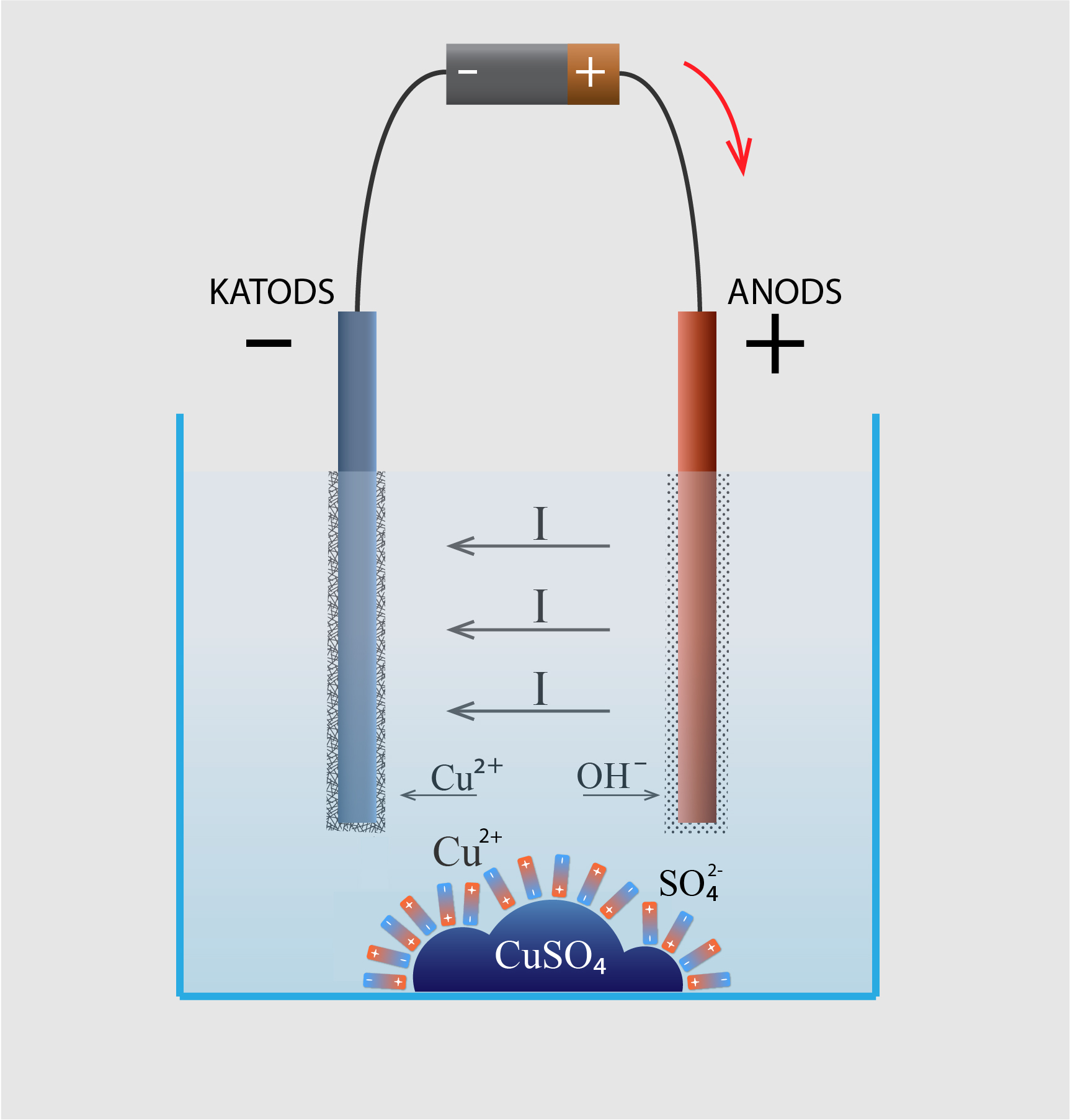
5.att. Vielas disociācija un elektrolīze
Vielas nogulsnēšanos uz katoda elektrolīzes procesā izmanto, lai iegūtu tīrus metālus. No metālu saturošām rūdām tiek izveidoti elektrolīta šķīdumi, kuros iegremdē pie sprieguma pieslēgtus elektrodus. Strāvai plūstot caur šķīdumu, uz elektroda izgulsnējas tīrs metāls. Metāla masu, kas nogulsnējas uz elektroda, nosaka formula m = kq, kur
k – vielas elektroķīmiskais ekvivalents (kg/C),
q – caur šķīdumu izplūdušā lādiņa lielums (C).
Iegūtā tīrā metāla masa ir atkarīga no katrai vielai raksturīgā elektroķīmiskā ekvivalenta. Dažādu vielu elektroķīmiskie ekvivalenti apskatāmi 6. attēlā.
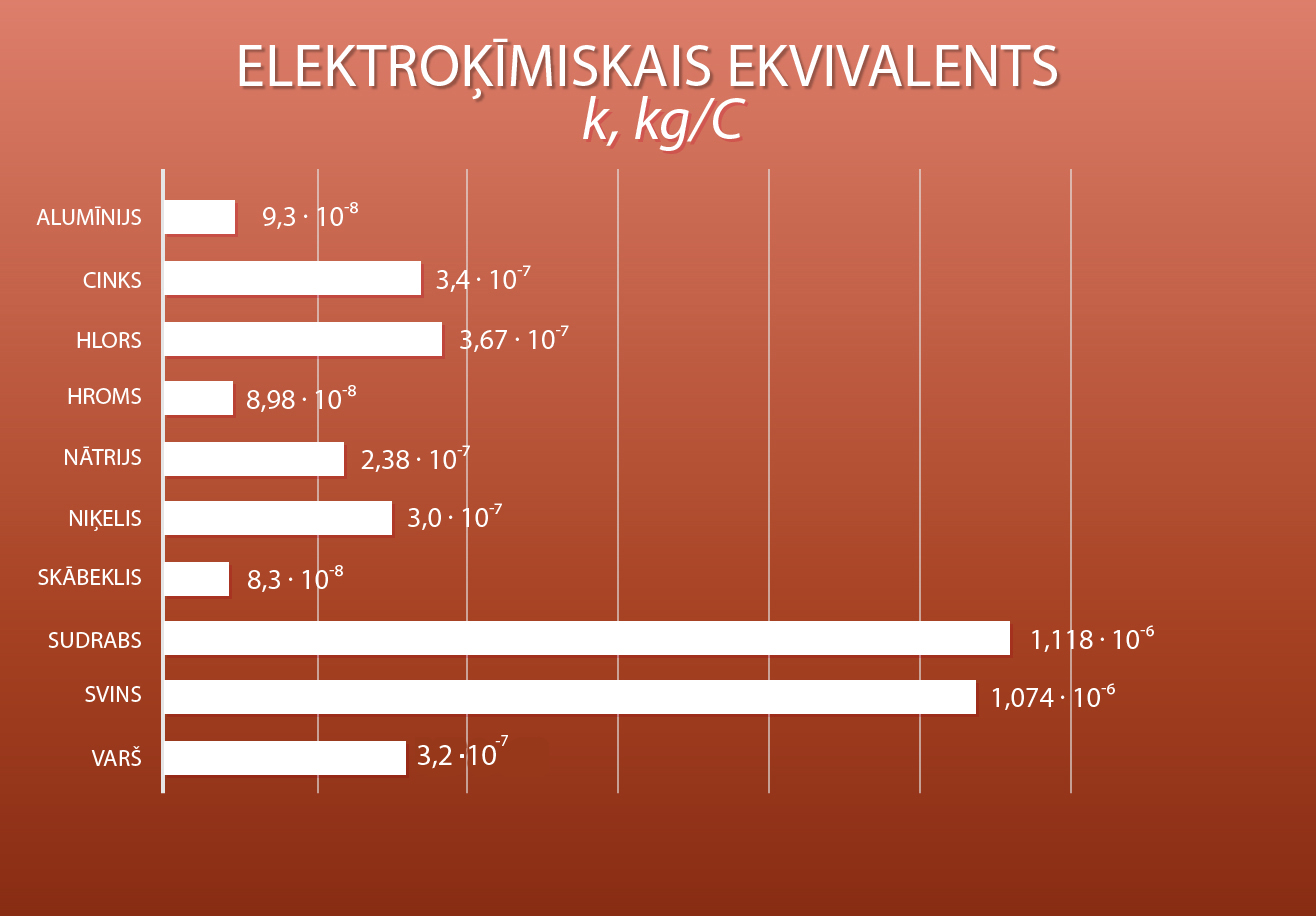
6.att. Dažādu vielu elektroķīmiskie ekvivalenti
Elektrolīzes procesu izmanto arī dažādu priekšmetu un detaļu pārklāšanai ar plānu metāla slānīti. Plaši izmanto hromēšanu jeb detaļu pārklāšanu ar plānu hroma slānīti. Šim nolūkam šķīdumu izveido no CrO3 un H2SO4, bet kā katodu izmanto detaļu, kurai vēlas izveidot pārklājumu (7. att. a). Pievienojot elektrodus spriegumam, pozitīvie hroma joni nonāk uz detaļas (katoda), iegūst sev trūkstošos elektronus un pārvēršas par hromu. Gala rezultātā detaļa ir vienmērīgi pārklāta ar plānu hroma kārtiņu (7. att. b).
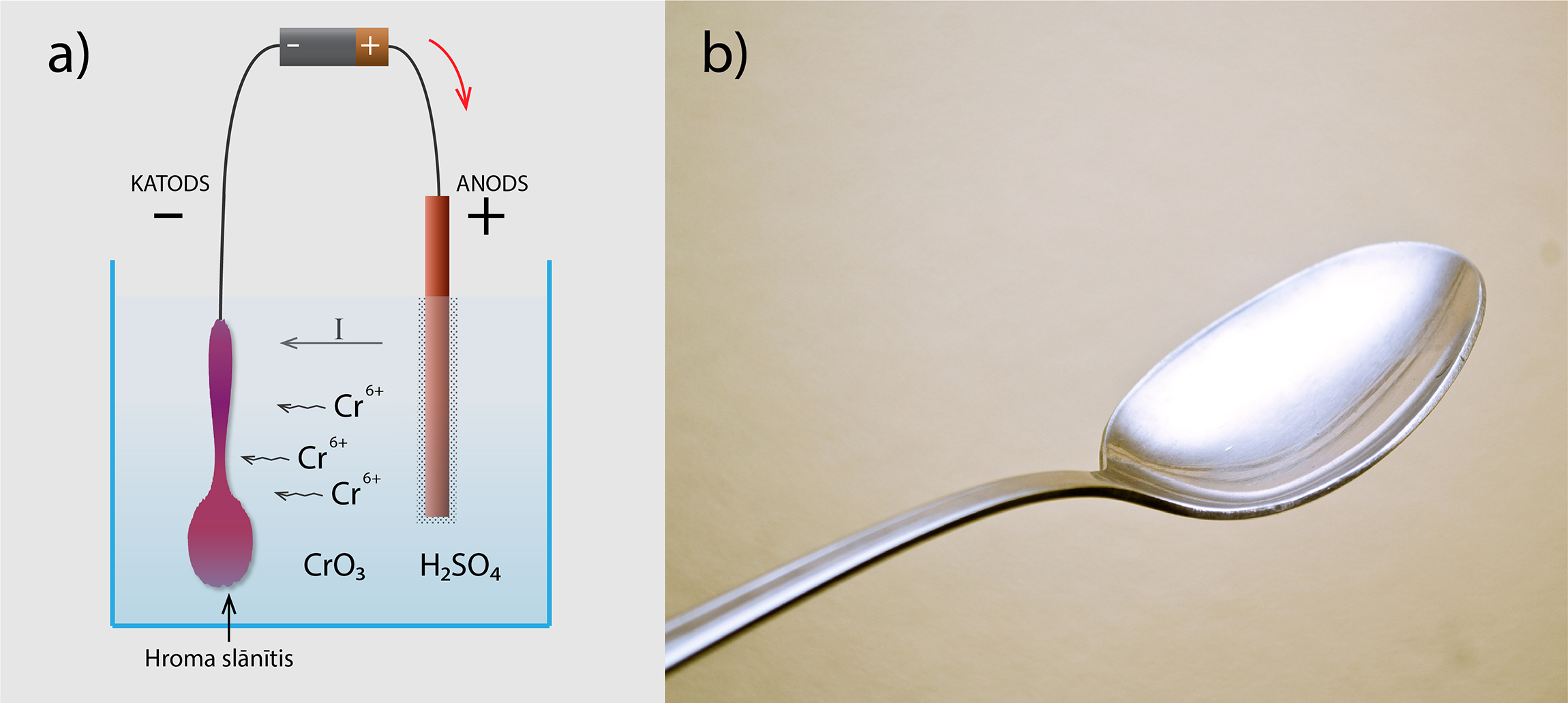
7.att. Hromēšanas process un rezultāts
Lai šķidrums vadītu elektrību, tajā ir jābūt brīviem lādiņnesējiem – joniem. Tīrā jeb destilētā ūdenī brīvo lādiņnesēju nav, līdz ar to šāds ūdens elektrību nevada (1. att. a). Tomēr, ja mēs kādā traukā ieliesim ūdeni no krāna un mēģināsim laist caur to strāvu, tad atklāsies, ka ūdens tomēr vada strāvu (1. att. b). Tas ir tādēļ, ka nedestilētā ūdenī atrodas piejaukuma molekulas, kas nodrošina elektrovadītspēju.
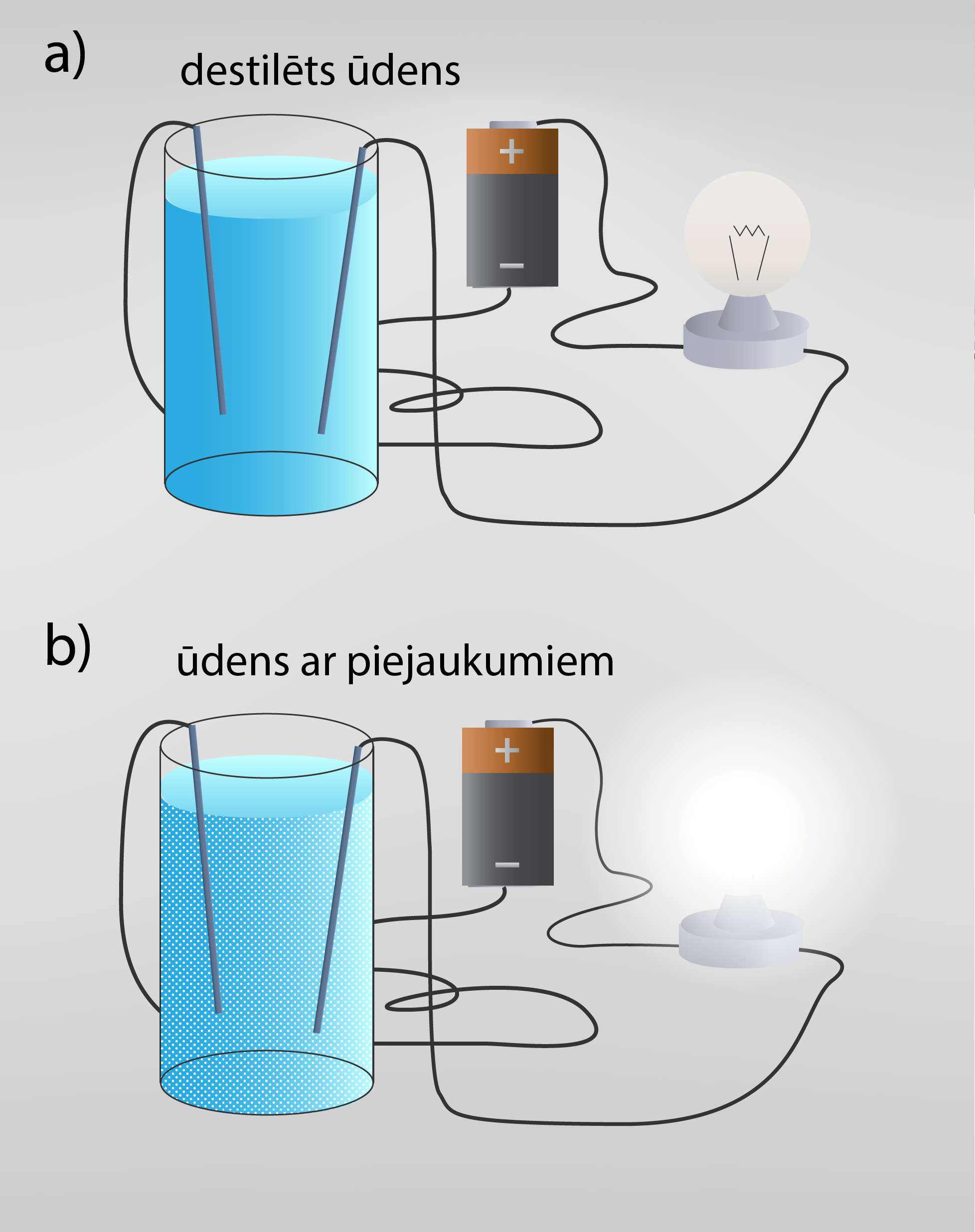
1.att. Ūdens elektrovadītspēja
Tas, ka metālos lādiņnesēji ir elektroni, tika konstatēts 1916. gadā veiktā eksperimentā. Šajā eksperimentā tika izmantota spole, kuras izvadi pieslēgti voltmetram (2. att.). Spole tika iegriezta ar lielu ātrumu un pēc tam strauji nobremzēta, taču elektroni inerces dēļ vēl kādu laiku turpināja kustību, līdz ar to voltmetrs uzrādīja strāvu. Eksperimentālo datu apstrāde liecināja, ka šīs strāvas izraisītāji ir elektroni.
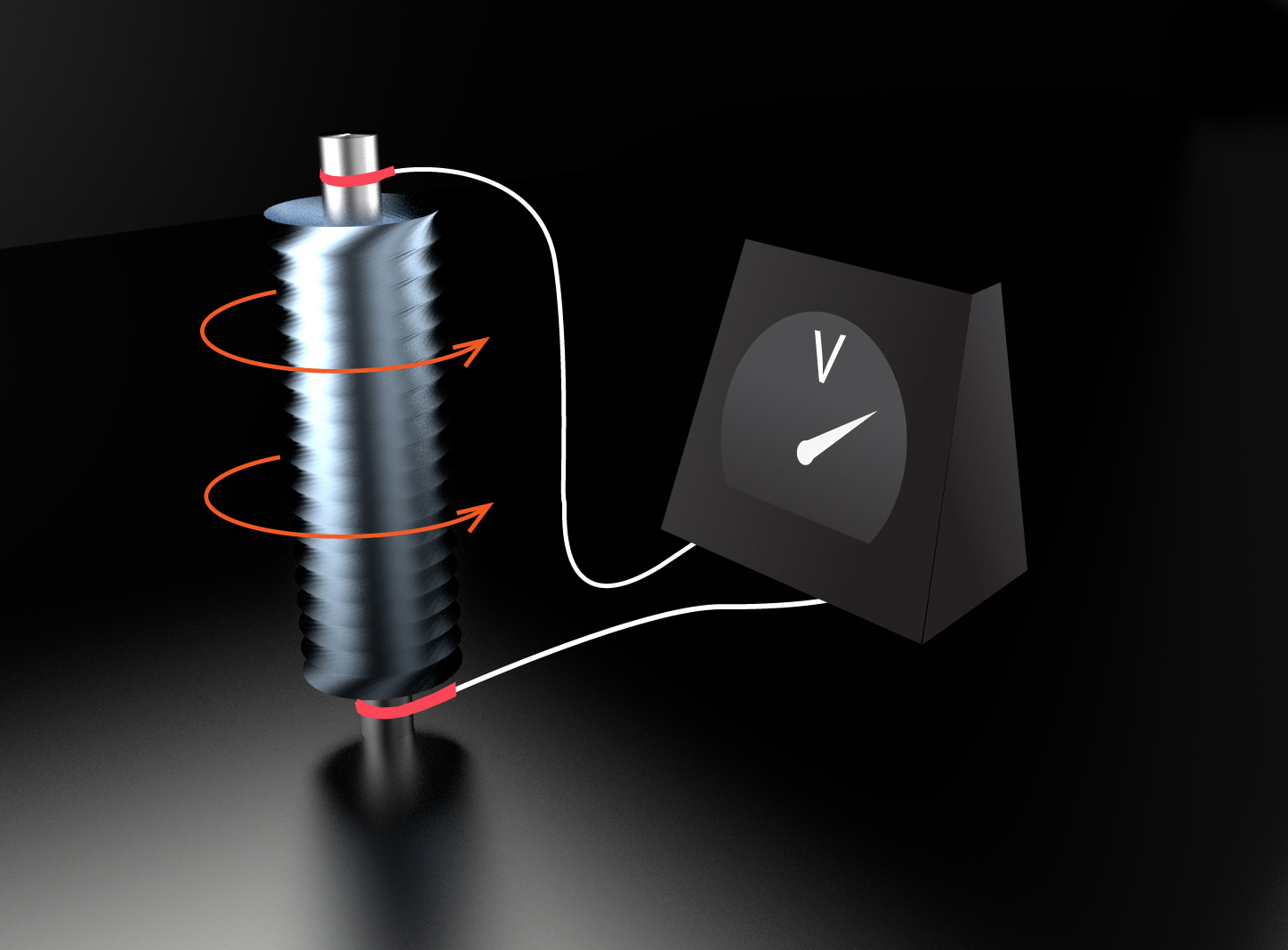
2.att. Spole ar tai pievienotiem slīdošiem kontaktiem
2. solī tika apskatīta metālu elektriskās pretestības atkarība no metāla temperatūras. Tuvojoties absolūtās nulles temperatūrai, metāla pretestība tiecas uz pretestības vērtību, ko izraisa metāla defekti. Tomēr dažiem metāliem, tuvojoties absolūtajai nullei, pretestība nevis vienmērīgi samazinās, bet lēcienveidīgi nokrīt līdz nullei, un metālam iestājas tā sauktais supravadošais stāvoklis (3. att.), kad elektrība tiek vadīta bez pretestības.
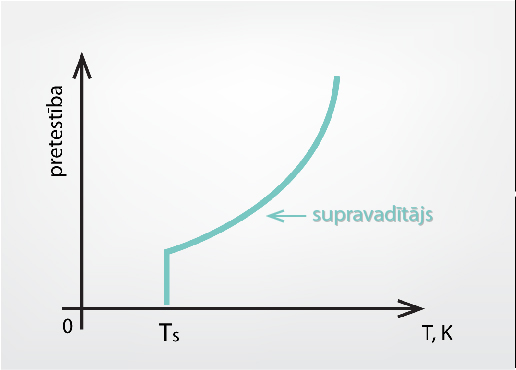
3.att. Metāla pāriešana uz supravadošu stāvokli
Metāliem, kuri var kļūt par supravadītājiem, šis stāvoklis iestājas zem kādas noteiktas temperatūras Ts (3. att.), ko sauc par supravadošu metālu kritisko temperatūru. Dažādu metālu temperatūras Ts atrodamas 4. attēlā. Mūsdienās tiek meklēti materiāli ar pēc iespējas augstāku kritisko temperatūru. Šobrīd materiāls ar visaugstāko kritisko temperatūru 134 K ir HgBa2Ca2Cu3O8.
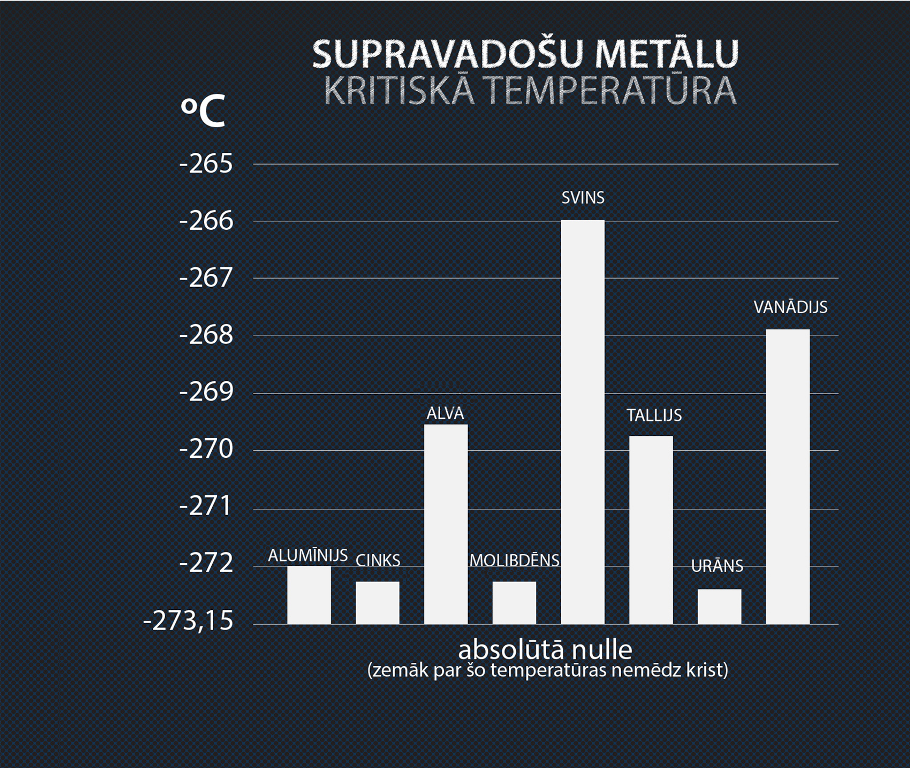
4.att. Supravadošu metālu kritiskās temperatūras
Supravadošiem materiāliem ir novērojams Meisnera efekts jeb īpašība no sevis izspiest magnētisko lauku. Ja apskatām supravadoša metāla lodīti, kuras temperatūra ir virs kritiskās temperatūras Ts, tad magnētiskais lauks, kā ierasts, caurvij šo lodīti (5. att. a). Ja lodītes temperatūra tiek nolaista zem Ts, tad magnētiskā lauka līnijas sāk no lodītes „izvairīties” (5. att. b). Meisnera efekts ir atbildīgs par to, ka virs supravadoša materiāla novietots magnēts levitē, ja materiāla temperatūra ir zem Ts (5. att. c).
Noskaties magnēta levitāciju virs supravadoša materiāla!
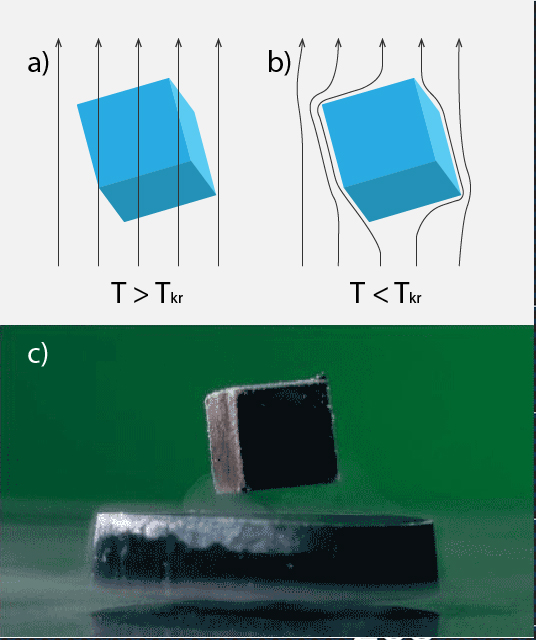
5.att. Meisnera efekts
Video par elektrolīzi:
Sāls kā elektrolīts:
Situācija, ūdens ir ļoti sāļš: